题目内容
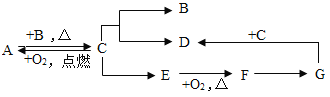
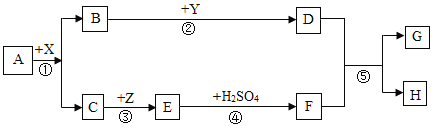
【题目】如图是模拟海水制盐的流程
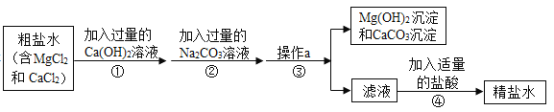
(1)为了证明第①步所加的Ca(OH)2溶液已过量,某同学取少量①反应后的上层清液,向其中继续加入Ca(OH)2溶液,若_____________(填实验现象),则证明Ca(OH)2溶液已过量。
(2)实验结束后,兴趣小组对滤液进行探究
(提出问题)滤液中除了含有水和氯化钠外,还含有哪些溶质?
(提出猜想)根据实验①②③的操作后,作出如下猜想
猜想一:由于在②中加入了过量的碳酸钠溶液,所以滤液中除了含有水和氯化钠外,还仅含过量的___________.
猜想二:由于在①加入了过量的氢氧化钙,发生反应生成了氢氧化镁和氯化钙,所以滤液中除了含有水和氯化钠外,只含有反应生成的氯化钙.
猜想三:由于②所加的过量碳酸钠在①之后,所加的碳酸钠把①中反应生成的氯化钙和过量的氢氧化钙全部除去,所以滤液中除了含有水和氯化钠外,还含有___________和___________.
(验证猜想)
步骤 | 实验操作 | 实验现象 | 推断 |
1 | 取少量滤液于试管中,加入过量的氯化钙溶液,振荡,静置 | ___________ | 滤液中还含有___________溶质 |
2 | 取步骤1反应后的混合液过滤后,取滤液少量于试管中加入__________ | ___________ | 滤液中还含有氢氧化钠 |
(实验结论)经过兴趣小组的实验分析,推出猜想三是正确的.
(反思与拓展)为了使制得的精盐水只含有水和氯化钠,步骤④的作用是除去杂质,请写出其中一个反应的化学方程式:___________________________________________.
【答案】无白色沉淀产生 碳酸钠 氢氧化钠 碳酸钠 产生白色沉淀 碳酸钠 无色酚酞试液 溶液变红色 NaOH+HCl═NaCl+H2O或Na2CO3+2HCl═2NaCl+H2O+CO2↑
【解析】
(1)为了证明第①步所加的Ca(OH)2溶液已过量,某同学取少量①反应后的上层清液,向其中继续加入Ca(OH)2溶液,若没有白色沉淀产生,则证明Ca(OH)2溶液已过量。
(2)[提出猜想]
猜想一:由于在②中加入了过量的碳酸钠溶液,所以滤液中除了含有水和氯化钠外,还仅含过量的碳酸钠 ;
猜想三:由于②所加的过量碳酸钠在①之后,所加的碳酸钠把①中反应生成的氯化钙和过量的氢氧化钙全部除去,所以滤液中除了含有水和氯化钠外,还含有氢氧化钠和碳酸钠。
[验证猜想]
步骤1:取少量滤液于试管中,加入过量的氯化钙溶液,振荡,静置,产生白色沉淀,滤液中还含有碳酸钠溶质;
步骤2:取步骤1反应后的混合液过滤后,取滤液少量于试管中加入无色酚酞试液, 溶液变红色滤液中还含有氢氧化钠。
[反思与拓展]
为了使制得的精盐水只含有水和氯化钠,步骤④的作用是除去杂质,可以用适量的稀盐酸来除去氢氧化钠和碳酸钠,化学方程式NaOH+HCl═NaCl+H2O或Na2CO3+2HCl═2NaCl+H2O+CO2↑。

【题目】小红学碱的性质时做了如图两个实验,并把两个实验的滤液都倒入了一个烧杯中,结果烧杯中产生了少量气泡,最终还有白色沉淀生成。回答下列问题:
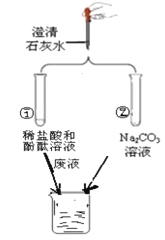
(1)实验①中酚酞溶液的作用___________________。
(2)实验②中滤液的溶质除有氢氧化钠外,还有________________(填化学式)。
(3)烧杯中产生白色沉淀物的化学方程式 ____________。
(4)小红对烧杯中的溶质的成分进行探究:小红认为除有NaCl外,还可能含有:
猜想1:还可能含有CaCl2
猜想2: 还可能含有___________,为了验证猜想1提出方案如下:
实验操作 | 实验现象 | 实验结论 |
取烧杯中的少量滤液于试管中,加入Na2CO3溶液 | _____________________ | 猜想1正确 |
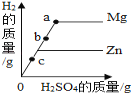
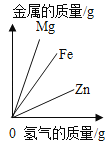
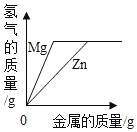
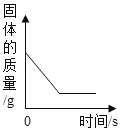
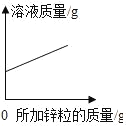
【题目】下列图象能正确反映对应变化关系的是( )
|
|
|
|
Mg、Zn、Fe与稀盐酸反应 | 等质量等质量分数的盐酸与足量的镁粉、锌粉 | 将铜片加入一定量的硝酸银溶液中 | 向一定质量的氯化锌和盐酸溶液中加入锌粒 |
A. A B. B C. C D. D