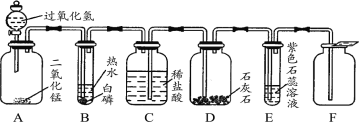
题目内容
【题目】为探究影响化学反应快慢的某些因素,某研究小组在实验过程中测定是数据(常温通常指20℃)如下表所示。
实验序号 | 过氧化氢溶液浓度/% | 过氧化氢溶液质量/g | 温度/℃ | 二氧化锰用量/g | 氧气体积/mL | 反应所需时间/s |
① | 5 | 12 | 20 | 0.2 | 125 | 11 |
② | 30 | 12 | 20 | 0.2 | 125 | 2 |
③ | 30 | 12 | 40 | / | 125 | 148 |
④ | 30 | 12 | 90 | / | 125 | 82 |
(1)通过实验①和②对比可知,化学反应快慢与_________有关;
(2)通过对比实验_________可知,化学反应快慢与温度的关系是___________。
(3)由上述实验可知,实验室用过氧化氢制取氧气的最合适的条件是______,该反应的文字表达式为________。
【答案】反应物浓度 ③④ 温度升高,反应速率加快 20℃时5%过氧化氢溶液中加入少量二氧化锰 ![]()
【解析】
(1)从表中分析可知:①②是过氧化氢浓度不同而其他的反应时各种量均相同,可知这一过程是考查反应物的浓度与反应速度的关系;
(2)③④则是温度不同其他条件相同,明显是对温度影响化学反应速度的探究;从结果看温度高时反应所用的时间较短,既反应的速度较快,温度低时反应的速度慢;
(3)实验室用过氧化氢制取氧气要求反应简便易操作,所以采用不加热而加催化剂的方法进行较合适,从易于收集的角度反应的速度不能太快也不能太慢,所以最合适的条件是20℃时5%过氧化氢溶液中加入少量二氧化锰;制取氧气的反应的文字表达式为:![]() 。
。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案【题目】课堂上、同学们对金属的性质展开如下探究,请你一起参与,并回答问题。
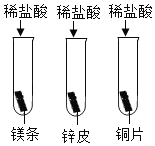
(1)甲小组进行了如图所示的实验,三支试管中分别放入用砂纸打磨过的镁条、锌皮和铜片,然后分别加入5mL稀盐酸,观察到的现象是______________________________,写出发生反应的一个化学方程式_________________________。
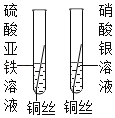
(2)乙小组设计实验、比较铁、铜、银的金属活动性强弱。
实验步骤(如图所示) | 实验现象 | 实验结论 |
| __________________ | 三种金属由强到弱的顺序是:铁>铜>银 |
请你再设计一种方案,得出与丙小组同学相同的结论,你选择的试剂是______。