题目内容
24、下图为某兴趣小组的同学们探究酸、碱溶液使酚酞溶液变色的实验.

通过实验能获得的结论是
(1)
实验完毕后同学们将所有废液倒入一只空的废液缸中,发现废液混合后得到的是无色液体,这一现象引起了该实验小组同学的注意,为了解以上三种物质之间的反应情况,他们决定取废液缸中的无色液体进行探究.
提出问题:溶液中的溶质是什么(不考虑酚酞)?
(2)猜想与假设:大家讨论后,甲认为:废液缸中无色液体的溶质可能是NaCl、CaCl2、HCl:乙同学认为也可能是
查阅资料:氯化钙和氯化钠的水溶液呈中性.
制定计划:甲为了证实自己的猜想是正确,完成以下实验探究.
实验设计:取废液缸中液体样品,向其中滴加硝酸银溶液,振荡;
现 象:产生白色沉淀
结 论:无色液体的溶质是NaCl、CaCl2、HCl
(3)交流评价:请你评价甲同学由实验现象获得的结论是否正确,并泌明理由.
(4)拓展应用:若经过实验证明乙的猜想是对的,清你设计实验来证明乙的猜想.

通过实验能获得的结论是
(1)
盐酸不能使无色酚酞试液改变颜色,氢氧化钠溶液和石灰水能使无色酚酞试液变成红色
.实验完毕后同学们将所有废液倒入一只空的废液缸中,发现废液混合后得到的是无色液体,这一现象引起了该实验小组同学的注意,为了解以上三种物质之间的反应情况,他们决定取废液缸中的无色液体进行探究.
提出问题:溶液中的溶质是什么(不考虑酚酞)?
(2)猜想与假设:大家讨论后,甲认为:废液缸中无色液体的溶质可能是NaCl、CaCl2、HCl:乙同学认为也可能是
NaCl、CaCl2
,他这样猜想的理由是氢氧化钠和氢氧化钙分别于盐酸恰好完全反应分别生成可溶于水的NaCl、CaCl2
.查阅资料:氯化钙和氯化钠的水溶液呈中性.
制定计划:甲为了证实自己的猜想是正确,完成以下实验探究.
实验设计:取废液缸中液体样品,向其中滴加硝酸银溶液,振荡;
现 象:产生白色沉淀
结 论:无色液体的溶质是NaCl、CaCl2、HCl
(3)交流评价:请你评价甲同学由实验现象获得的结论是否正确,并泌明理由.
| 正确或错误 | 理由 | |
| 甲同学 |
取样,滴加紫色石蕊试液,石蕊试液不变色,则可证明乙的猜想正确
.分析:(1)酸性溶液不能使无色酚酞试液改变颜色,碱性溶液能使无色酚酞试液变成红色.
(2)根据“酸与碱会发生中和反应生成盐与水”分析.
(3)NaCl、CaCl2、HCl均能电离出氯离子,均会与硝酸银反应生成氯化银沉淀.
(4)乙的猜想是无盐酸存在,因NaCl、CaCl2显中性,故滴加石蕊后不变色即为没有盐酸存在.
(2)根据“酸与碱会发生中和反应生成盐与水”分析.
(3)NaCl、CaCl2、HCl均能电离出氯离子,均会与硝酸银反应生成氯化银沉淀.
(4)乙的猜想是无盐酸存在,因NaCl、CaCl2显中性,故滴加石蕊后不变色即为没有盐酸存在.
解答:解:(1)酸性溶液不能使无色酚酞试液改变颜色,碱性溶液能使无色酚酞试液变成红色,所以盐酸不能使无色酚酞试液改变颜色,氢氧化钠溶液和石灰水能使无色酚酞试液变成红色这也是反应出现的现象.故答案为:盐酸不能使无色酚酞试液改变颜色,氢氧化钠溶液和石灰水能使无色酚酞试液变成红色.
(2)酸与碱会发生中和反应生成盐与水,所以氢氧化钠氢氧化钙均能与盐酸反应,生成氯化钙与氯化钠.故答案为:NaCl、CaCl2;氢氧化钠和氢氧化钙分别于盐酸恰好完全反应分别生成可溶于水的NaCl、CaCl2.
(3)NaCl、CaCl2、HCl均能电离出氯离子,均会与硝酸银反应生成氯化银沉淀.
故答案为:
(4)乙的猜想是无盐酸存在,因NaCl、CaCl2显中性,故滴加石蕊后不变色即为没有盐酸存在,变红既有盐酸.
故答案为:取样,滴加紫色石蕊试液,石蕊试液不变色,则可证明乙的猜想正确
(2)酸与碱会发生中和反应生成盐与水,所以氢氧化钠氢氧化钙均能与盐酸反应,生成氯化钙与氯化钠.故答案为:NaCl、CaCl2;氢氧化钠和氢氧化钙分别于盐酸恰好完全反应分别生成可溶于水的NaCl、CaCl2.
(3)NaCl、CaCl2、HCl均能电离出氯离子,均会与硝酸银反应生成氯化银沉淀.
故答案为:
| 正确或错误 | 理由 | |
| 甲同学 | 错误 | NaCl、CaCl2、HCl均能电离出氯离子,均会与硝酸银反应生成氯化银沉淀,无法检验氯离子是否来源于盐酸. |
(4)乙的猜想是无盐酸存在,因NaCl、CaCl2显中性,故滴加石蕊后不变色即为没有盐酸存在,变红既有盐酸.
故答案为:取样,滴加紫色石蕊试液,石蕊试液不变色,则可证明乙的猜想正确
点评:此题是对酸碱盐之间反应的考查,利用复分解反应结合指示剂与酸碱的反应现象是解题的关键.

练习册系列答案
相关题目

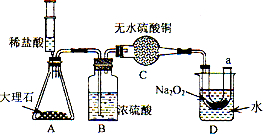
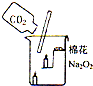 27、过氧化钠(Na2O2)是一种黄色固体.某次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入右图烧杯中,缓慢倒人CO2后发现处于下位的蜡烛先熄灭,上位的后熄灭,同时又惊奇的发现棉花燃烧起来.
27、过氧化钠(Na2O2)是一种黄色固体.某次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入右图烧杯中,缓慢倒人CO2后发现处于下位的蜡烛先熄灭,上位的后熄灭,同时又惊奇的发现棉花燃烧起来.