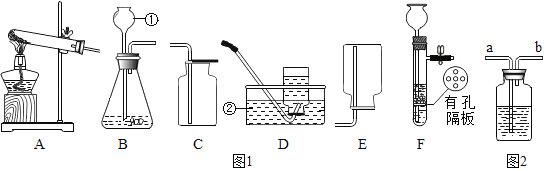
题目内容
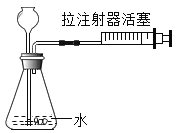
【题目】以下是某研究小组探究影响反应速率部分因素的相关实验数据。(注:在制取气体的实验中,常用收集相同体积的气体所用时间来判断反应速率的快慢,所用时间越短反应的速率就越快。)
实验序号 | H2O2溶 液浓度% | H2O2溶液体积/mL | 温度℃ | MnO2的用量/g | 收集氧气的体积/mL | 反应所需 的时间/s |
① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
③ | 30 | 5 | 35 | 2 | 49.21 | |
④ | 30 | 5 | 55 | 2 | 10.76 |
(1)写出该反应的文字表达式:____;
(2)通过实验①和②对比可知,化学反应速率与____有关;从实验____和____对比可知,化学反应速率与温度的关系是:____。
(3)此反应中二氧化锰的作用是:____。
(4)在实验中,该小组同学发现,二氧化锰颗粒大小可能会影响反应速率,请设计实验方案进行验证:_____。
【答案】过氧化氢![]() 水+氧气 反应物浓度(或浓度) ③ ④ 在相同条件下,温度越高化学反应速率越快 催化作用 相同温度下,分别将等浓度过氧化氢与等质量不同颗粒大小的二氧化锰充分混合,测定收集相同体积的氧气所需的时间;如果时间不同,二氧化锰颗粒大小会影响反应速率;反之则不影响反应速率。
水+氧气 反应物浓度(或浓度) ③ ④ 在相同条件下,温度越高化学反应速率越快 催化作用 相同温度下,分别将等浓度过氧化氢与等质量不同颗粒大小的二氧化锰充分混合,测定收集相同体积的氧气所需的时间;如果时间不同,二氧化锰颗粒大小会影响反应速率;反之则不影响反应速率。
【解析】
(1)过氧化氢在二氧化锰催化作用下分解生成水和氧气,该反应的文字表达式:过氧化氢![]() 水+氧气;
水+氧气;
(2)实验①和②中其他条件相同,只有过氧化氢浓度不同,反应现象不同,通过实验①和②对比可知,化学反应速率与反应物的浓度有关;实验③和④中其他条件相同中,只有过氧化氢温度不同,温度越高反应速率越快,从实验③和④对比可知,化学反应速率与温度的关系是在相同条件下,温度越高化学反应速率越快;
(3)此反应中二氧化锰的作用是催化作用(或加快反应速度);
(4)探究二氧化锰颗粒大小影响反应速率,根据控制变量原理,实验方案是相同温度下,分别将等浓度过氧化氢与等质量不同颗粒大小的二氧化锰充分混合,测定收集相同体积的氧气所需的时间;如果时间不同,二氧化锰颗粒大小会影响反应速率;反之则不影响反应速率。

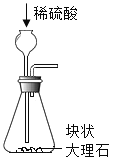
【题目】空气是人类赖以生存的宝贵资源,空气成分的发现其实经历了很长时间的研究,了解空气相关知识后,我们要学会保护空气,保卫蓝天。
(1)空气中含量排前三位的气体依次是____(填名称)。
(2)空气成分的测定:
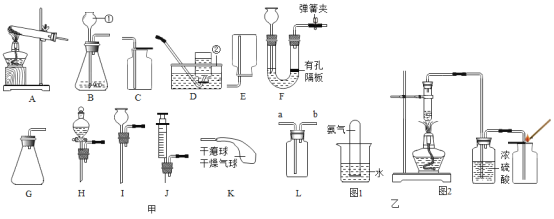
①在二百多年前,拉瓦锡用汞(水银)用定量的方法研究了空气的成分(实验装置如图)该实验中选择使用汞的优点有____。
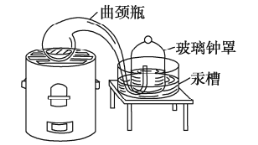
A 实验过程中没有污染
B 在汞槽中起到液封作用
C 生成的化合物加热分解又能得到汞和氧气
D 能将密闭装置内空气中的氧气几乎耗尽
②现在我们可以利用图甲装置测定空气中氧气的含量并结合现代传感器技术,测得过程中容器内气体压强、温度、氧气浓度的变化趋势如图乙所示。
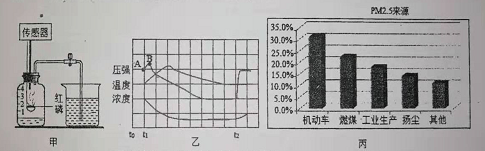
①t2时打开止水夹,最终集气瓶中水平面大约上升至刻度_____处。
②结合曲线,解释AB段气体压强变化的原因是_____。
(3)空气的保护
①图丙是某地PMs来源分布图。据此,下列措施对减少PM1s效果最不明显的是_____。
A 减少汽车的数量
B 用风能与太阳能发电替代燃煤发电
C 减少工业生产中二氧化碳的排放
②除了上述PM2.5外,下列也属于空气污染物的是_____。
A 臭氧
B 一氧化碳
C 二氧化硫
D PM10
(4)实验反思与再探究:
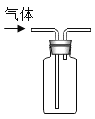
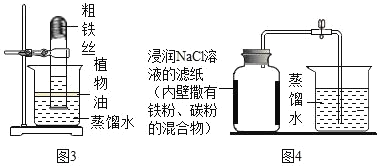
(实验探究1)利用红磷测定空气中氧气含量时,使用氧气浓度传感器测得反应后装置内氧气浓度为8.85%,实验误差比较大,于是小明利用铁丝生锈的实验(装置如下图1)测定氧气含量,通过7天测得的数据计算空气中氧气的含量为19.13%。
(交流与讨论)与用红磷燃烧的方法相比,用铁丝生锈的方法测定的主要优点及原因:____。
(实验探究2)探究1实验时间较长,为了加快反应速率,小明通过查阅资料,利用铁粉、炭粉、氯化钠等物质又进行了实验(装置如下图2),8分钟后测得的数据如表:
实验前的体积 | 实验后的体积 | |
集气瓶内空气 | 烧杯内蒸馏水 | 烧杯内剩余蒸馏水 |
131mL | 90.0mL | 63.6mL |
请计算出空气中氧气含量______(计算结果保留一位小数)
(5)通过上述几个测定空气中氧气含量的实验可以看出,选择____(填物质名称)进行实验,可较为快速地完成实验并减小实验误差。
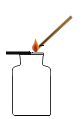
【题目】某同学欲通过实验证明“二氧化锰是氯酸钾受热分解的催化剂”。他设计并完成了如表所示的探究实验:
(1)请你帮他完成下表划线部分的空格:
实验操作 | 实验现象 | 实验结论或总结 | ||
各步骤结论 | 总结 | |||
实验一 | 将氯酸钾装在试管中加热至融化,再往试管中伸入带火星的木条。 | 木条复燃 | 氯酸钾受热能分解产生氧气,但是反应速率慢。 文字表达式为:______________ | 二氧化锰是氯酸钾受热分解的催化剂。 |
实验二 | 加热装在试管中的二氧化锰,然后往试管中伸入带火星的木条。 | 木条不复燃 | ____________ | |
实验三 | ___________________ | 木条迅速复燃 | _____________ | |
(2)在该同学的三个探究实验中,实验一和实验二起的作用是_______________。
(3)张敏同学认为仅由上述实验还不能完全得出“二氧化锰是氯酸钾受热分解的催化剂”的结论,她补充设计了两个方面的探究实验:
第一方面的实验操作中包含了两次称量,其目的是:_____________。
第二方面的实验是要验证从反应后的剩余物中分离出的MnO2是否还能加快KClO3的分解。此实验的目的是:____________________。