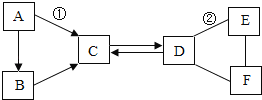
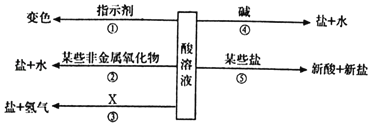
��Ŀ����
����Ŀ�������й��������Ƽ���������У�����ȷ���ǣ�������
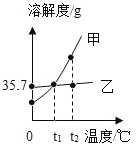
��������������Ҫ��Ӧԭ�����£�NaCl+NH3+CO2+H2O�TNaHCO3+NH4Cl 2NaHCO3![]() Na2CO3+CO2��+H2O��
Na2CO3+CO2��+H2O��
A.����ʱ���ȶ��ԣ�̼���ƣ�̼������
B.��ʳ���ƴ����ҪҪ��̼����Ԫ�ص�����
C.���Ʊ���ʳ��ˮʱ����ͨ�����������ʳ�ε��ܽ��
D.��ʳ������ͨ�백����������ʹ��Һ�ʼ��ԣ��ٽ�������̼������
���𰸡�C
��������
A������2NaHCO3![]() Na2CO3+CO2��+H2O�����з����жϣ�
Na2CO3+CO2��+H2O�����з����жϣ�
B�����������غ㶨�ɣ���Ӧǰ��Ԫ������䣬���з����жϣ�
C��������ܽ���ܵ����ʺ��ܼ����������ʵ�Ӱ�죬ͬʱ�����¶ȵ�Ӱ�죬����Թ�����ܽ�ȼ�����Ӱ�죮
D�����ݰ�����ˮ��Һ�Լ��ԣ����з����жϡ�
A����2NaHCO3![]() Na2CO3+CO2��+H2O��֪������ʱ���ȶ��ԣ�̼���ƣ�̼�����ƣ���ѡ����ȷ�����������⣻
Na2CO3+CO2��+H2O��֪������ʱ���ȶ��ԣ�̼���ƣ�̼�����ƣ���ѡ����ȷ�����������⣻
B���������غ㶨�ɣ���Ӧǰ��Ԫ������䣬�����к���̼Ԫ�غ���Ԫ�أ���ʳ���ƴ����ҪҪ��̼����Ԫ�ص����ʣ���ѡ����ȷ�����������⣻
C���ܽ������һ���¶��£�ij����������100g�ܼ���ﵽ����״̬���ܽ���������������費�����ʳ�ε��ܽ�ȣ���ѡ����������⣻
D��������ˮ��Һ�Լ��ԣ����������̼��Ӧ����ʳ������ͨ�백����������ʹ��Һ�ʼ��ԣ��ٽ�������̼�����գ���ѡ������������⣻
��ѡ��C��

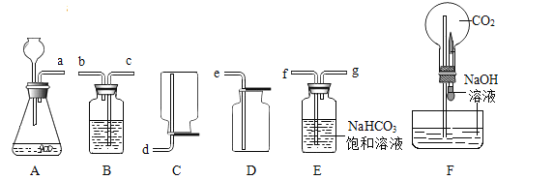
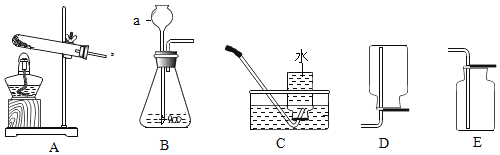
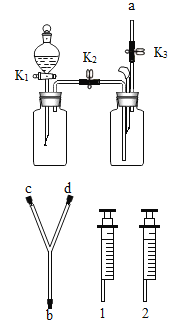
����Ŀ��������ͼװ�ý���ʵ�顣ʵ��ǰK1��K2��K3���ѹرա�
���� װ�� | ��ʵ��1��̽��ȼ������ | ��ʵ��2��̽��CO2��NaOH��Ӧ |
| ��. A�м���������MnO2���壬��Һ©����ʢ��H2O2��Һ�� ��. B�г����ܿڴ�����ʢ�а���������ע��80������ˮ����Һ���û�¶˵��ܿڡ� | ��. A�м���������Na2CO3���壬��Һ©����ʢ��ϡH2SO4��Һ�� ��. ע����1��2�зֱ���NaOH��Һ��ϡ���� |
��1�����װ�������ԣ�����K1�رգ���K2��K3����B�м�ˮ��Һ���û�¶˵��ܿڣ�������סAƿ��ڣ�˵��װ�õ�������������õ�������________�����������������Ҳ����������á�
��2��ʵ��1�У�����H2O2��Һǰ��ˮ�еİ��ײ�ȼ�գ���K1��K2��K3����H2O2��Һ����A�У��ر�K1���۲쵽________��֤��ȼ�յ�����֮һ�ǿ�ȼ���������Ӵ���B�з�����Ӧ�Ļ�ѧ����ʽΪ________________��
��3��ʵ��2�У���K1��K2��K3����A��ע��������ϡH2SO4���ر�K1��һ��ʱ��֮����ȼ�ŵ�ľ������a�ڴ���ľ��Ϩ�𣬹ر�K2, ����ʵ�������Ŀ����______����ʱ����װ��B��a�ӿں�Y�ܵ�b�ӿ����ӣ���ע����1�е���Һ���뵽B�У��۲쵽�������Ա��Ϊ��һ��֤��������̼����������ȷʵ�����˷�Ӧ������ʵ��IJ�����������_________________��