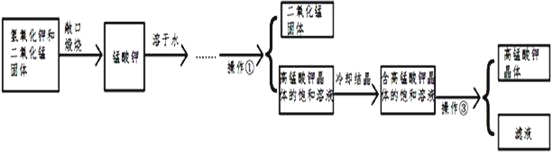
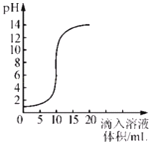
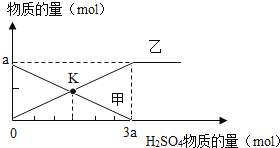
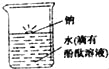题目内容
【题目】某校化学研究性学习小组共同探究制取气体的原理、方法及性质的有关实验.
(1)甲同学将所学气体制取的知识整理如下,请你帮助他完成相关内容.
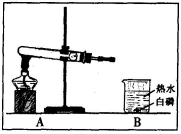
①写出图中有标号仪器的名a .
②用双氧水和二氧化锰来制取氧气时,可选用的发生装置是 (填序号,下同).
③反应结束后,欲将二氧化锰回收再利用应进行的主要操作是 .
④实验室常用氯化铵固体与碱石灰固体共热来制取氨气(NH3),应选择的发生装置是 .
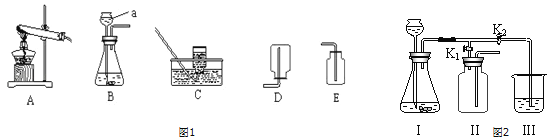
(2)乙同学设计的实验装置(如图2),既可用于制取气体,又可用于探究物质性质.
①当打开K1、关闭K2时,利用I、Ⅱ装置可进行的实验是 (填序号).
a.大理石与稀盐酸反应制取二氧化碳b.锌与稀硫酸反应制取氢气
②当打开K2、关闭K1,利用I、Ⅲ装置可以检验生成的二氧化碳,则装置I中发生反应的化学方程式为 ;若要证明二氧化碳与水发生反应,烧杯中应放入的试剂是 .
【答案】(1)①长颈漏斗;②B;③过滤;④A;
(2)b;CaCO3+2HCl=CaCl2+H2O+CO2↑;紫色石蕊试液;
【解析】
试题分析:长颈漏斗方便加液体药品,制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;若要证明二氧化碳与水发生反应,烧杯中应放入的试剂是紫色石蕊试液.当打开K1、关闭K2时,利用I、Ⅱ装置可进行的实验是:锌与稀硫酸反应制取氢气,因为进气管短,说明收集的气体密度比空气小.
解:(1)长颈漏斗方便加液体药品,如果用双氧水和二氧化锰制氧气就不需要加热,二氧化锰不溶于水,欲将二氧化锰回收再利用应进行的主要操作是过滤;实验室常用氯化铵固体与碱石灰固体共热来制取氨气(NH3),应该加热;故答案为:①长颈漏斗;②B;③过滤;④A;
(2)当打开K1、关闭K2时,利用I、Ⅱ装置可进行的实验是:锌与稀硫酸反应制取氢气,因为进气管短,说明收集的气体密度比空气小.实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,配平即可;若要证明二氧化碳与水发生反应,烧杯中应放入的试剂是紫色石蕊试液;故答案为:b;CaCO3+2HCl=CaCl2+H2O+CO2↑;紫色石蕊试液;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】如表是元素周期表的一部分:
族 周期 | IA | 0 | ||||||
1 | 1 H 1.008 | ⅡA | ⅢA | ⅣA | V A | ⅥA | ⅦA | 2 He 4.003 |
2 | 3 Li 6.941 | 4 Be 9.012 | 5 B 10.8l | 6 C 12.01 | 7 N 14.0l | 8 O 16.00 | 9 F 19.00 | 10 Ne 20.18 |
3 | 11 Na 22.99 | 12 Mg 24.31 | 13 Al 26.98 | 14 Si 28.09 | 15 P 30.97 | 16 S 32.06 | 17 Cl 35.45 | 18 Ar 39.95 |
(1)原子序数是12的元素符号为 ;Be元素的相对原子质量为 ;
(2)相对原子质量为22.99的元素属 (填“金属”或“非金属”)元素;Ne的化学性质比较 (填“稳定”或“不稳定”).
(3)如图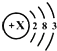 为某元素的原子结构示意图,该元素位于周期表中第 周期.
为某元素的原子结构示意图,该元素位于周期表中第 周期.
X= ,第一层内有 个电子,最外层有 个电子,该原子在化学反应中容易 (填“失去”或“得到”)电子,该原子的元素符号是 ,元素名称是 ,属于 (填“金属元素”或“非金属元素”).