题目内容
【题目】向amolFe2O3中滴加稀硫酸,随着硫酸的加入,有关量的变化见图,分析错误的是( )
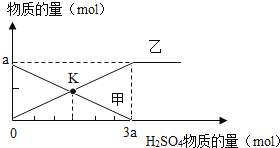
A. 曲线甲表示氧化铁的物质的量
B. 曲线乙表示生成水的物质的量
C. K点时溶液中铁元素的物质的量是amol
D. K点时硫酸铁和剩余氧化铁物质的量相等
【答案】B
【解析】试题分析:反应的化学方程式为:Fe2O3+ 3H2SO4= Fe 2 (SO4)3+3H2O, A、随着反应的进行,Fe2O3的质量越来越小,最后减小为零,正确;B、Fe2O3与H2SO4之间的对应关系为:Fe2O3-----3H2SO4,而H2SO4与H2O,之间的对应关系是H2SO4---H2O ,故曲线乙不能表示生成水的质量,错误;C、1 mol Fe 2 (SO4)3中含有2 mol的 Fe 离子,K点时表示反应掉一半Fe2O3,此时生成0.5a mol Fe 2 (SO4)3,故K点时溶液中铁元素的物质的量是a mol,正确;D、因为K点时表示反应掉一半Fe2O3,故K点时硫酸铁和剩余氧化铁物质的量相等,正确。故选B。

练习册系列答案
相关题目