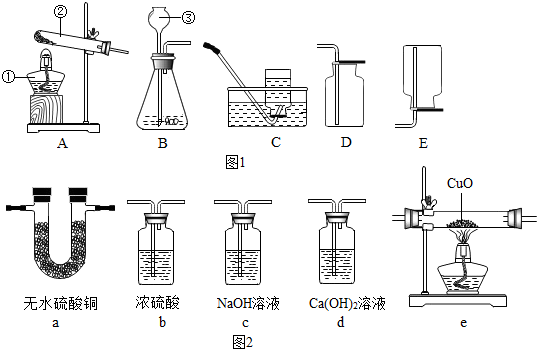
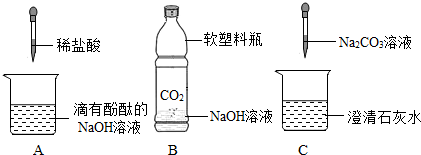
题目内容
煤燃烧产生的废气中含有SO2,用NaOH、Na2SO3溶液可将90%以上的SO2吸收.涉及的反应有
①2NaOH+SO2═Na2SO3+H2O ②Na2SO3+SO2+H2O═2NaHSO3 ③NaHSO3+NaOH═Na2SO3+H2O
下列说法中,不正确的是( )
①2NaOH+SO2═Na2SO3+H2O ②Na2SO3+SO2+H2O═2NaHSO3 ③NaHSO3+NaOH═Na2SO3+H2O
下列说法中,不正确的是( )
| A、反应②是化合反应 |
| B、可循环使用的物质是Na2SO3 |
| C、NaHSO3中硫元素的化合价是+6 |
| D、煤脱硫后燃烧可防止煤燃烧产生SO2 |
考点:酸雨的产生、危害及防治,有关元素化合价的计算,反应类型的判定
专题:化学与环境保护
分析:A、化合反应是指由两种或两种以上物质反应生成一种物质的反应;
B、根据反应过程分析可知,亚硫酸钠可以循环使用;
C、依据在化合物中元素的化合价代数和为零求出硫元素的化合价;
D、根据反应物结合质量守恒定律判断.
B、根据反应过程分析可知,亚硫酸钠可以循环使用;
C、依据在化合物中元素的化合价代数和为零求出硫元素的化合价;
D、根据反应物结合质量守恒定律判断.
解答:解:A、反应②是由三种物质反应生成一种物质,符合“多变一”的化合反应特点.故正确;
B、应②中消耗Na2SO3吸收二氧化硫,而在反应①和③都有生成Na2SO3,因此在此过程中Na2SO3可循环使用.故正确;
C、根据在NaHSO3中钠、氢元素的化合价是+1价,氧元素化合价是-2价,可知NaHSO3中硫元素的化合价是+4.故错误;
D、煤在燃烧时,会产生大量的SO2,对环境产生污染,工业上可用脱硫方法减少煤燃烧产生的SO2.故正确.
故选C.
B、应②中消耗Na2SO3吸收二氧化硫,而在反应①和③都有生成Na2SO3,因此在此过程中Na2SO3可循环使用.故正确;
C、根据在NaHSO3中钠、氢元素的化合价是+1价,氧元素化合价是-2价,可知NaHSO3中硫元素的化合价是+4.故错误;
D、煤在燃烧时,会产生大量的SO2,对环境产生污染,工业上可用脱硫方法减少煤燃烧产生的SO2.故正确.
故选C.
点评:利用已有的知识对新的情境中的新问题进行分析,需要具备知识迁移能力,只有这样才能对相关方面的问题做出正确的判断.

练习册系列答案
相关题目
根据你的生活经验,下列做法不正确的是( )
| A、炒菜时油锅不慎着火,迅速盖上锅盖 |
| B、运动出汗之后,可适当饮用食盐水 |
| C、水杯中的水垢(主要成份是碳酸钙)可以用食醋洗掉 |
| D、用燃着的火柴检查液化气钢瓶是否漏气 |
在氧气、二氧化硫、二氧化碳、二氧化锰四种物质中下列叙述正确的是( )
| A、都含有一个氧分子 |
| B、都含有氧元素 |
| C、都是氧化物 |
| D、都是化合物 |
下列物质属于氧化物的是( )
| A、O2 |
| B、H2O |
| C、NaCl |
| D、Fe |
从世界范围来看,造成空气污染的有害气体主要是( )
| A、二氧化硫、氧气、氮气 |
| B、二氧化碳、一氧化炭、臭氧 |
| C、二氧化氮、二氧化硫、一氧化碳 |
| D、二氧化硫、可吸入颗粒、二氧化碳 |
下列图示实验操作中正确的是( )
A、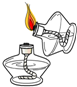 |
B、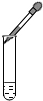 |
C、 |
D、 |