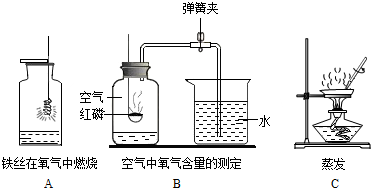
题目内容
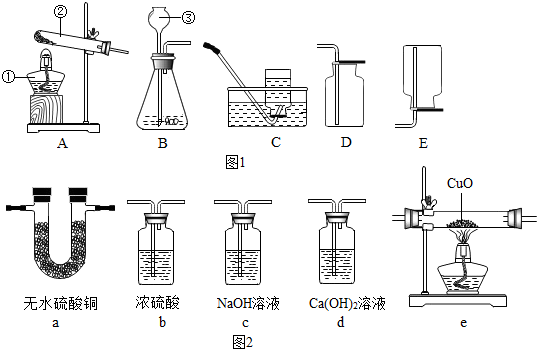
实验室常用图1装置来制取气体:
(1)用高锰酸钾制取氧气的化学方程式为 ,实验时应在试管口放一团棉花,其作用是 .
(2)制取二氧化碳应选用的发生和收集装置是(填字母序号,下同) ,反应的化学方程式
为 .
(3)实验室常用加热NH4Cl和Ca(OH)2固体混合物的方法制取氨气(NH3),则制取氨气的发生装置应选用 .收集氨的装置只能用E,由此可知氨气应具有的性质是 .
(4)图2为常见的实验装置(各具用途),根据下列要求回答问题.装置可重复使用.
①将含水蒸气的氢气干燥后还原氧化铜,则该气体先要通过装置 .(填字母序号,下同)
②如果验证混合气体中有H2、CO和H2O,则需连接的仪器顺序为 .

(1)用高锰酸钾制取氧气的化学方程式为
(2)制取二氧化碳应选用的发生和收集装置是(填字母序号,下同)
为
(3)实验室常用加热NH4Cl和Ca(OH)2固体混合物的方法制取氨气(NH3),则制取氨气的发生装置应选用
(4)图2为常见的实验装置(各具用途),根据下列要求回答问题.装置可重复使用.
①将含水蒸气的氢气干燥后还原氧化铜,则该气体先要通过装置
②如果验证混合气体中有H2、CO和H2O,则需连接的仪器顺序为
考点:常用气体的发生装置和收集装置与选取方法,常见气体的检验与除杂方法,气体的干燥(除水),实验室制取氧气的反应原理,二氧化碳的实验室制法,书写化学方程式、文字表达式、电离方程式
专题:常见气体的实验室制法、检验、干燥与净化
分析:(1)高锰酸钾受热时能够分解生成锰酸钾、二氧化锰和氧气;
为了防止高锰酸钾进入导管,通常在试管口塞一团棉花;
(2)实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,反应不需要加热,大理石和石灰石的主要成分是碳酸钙,能和稀盐酸反应生成氯化钙、水和二氧化碳;
二氧化碳能够溶于水,密度比空气大;
(3)根据制取气体的反应物状态、反应条件、气体的性质可以选择发生装置,根据收集装置可以判断气体的性质;
(4)浓硫酸具有吸水性,可以用来干燥氧气、氢气、二氧化碳等物质;
加热条件下,氢气和氧化铜反应生成铜和水,一氧化碳和氧化铜反应生成铜和二氧化碳;
无水硫酸铜是白色固体,能和水反应生成蓝色的五水硫酸铜;
二氧化碳能使澄清石灰水变浑浊.
为了防止高锰酸钾进入导管,通常在试管口塞一团棉花;
(2)实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,反应不需要加热,大理石和石灰石的主要成分是碳酸钙,能和稀盐酸反应生成氯化钙、水和二氧化碳;
二氧化碳能够溶于水,密度比空气大;
(3)根据制取气体的反应物状态、反应条件、气体的性质可以选择发生装置,根据收集装置可以判断气体的性质;
(4)浓硫酸具有吸水性,可以用来干燥氧气、氢气、二氧化碳等物质;
加热条件下,氢气和氧化铜反应生成铜和水,一氧化碳和氧化铜反应生成铜和二氧化碳;
无水硫酸铜是白色固体,能和水反应生成蓝色的五水硫酸铜;
二氧化碳能使澄清石灰水变浑浊.
解答:解:(1)用高锰酸钾制取氧气的化学方程式为:2KMnO4
K2MnO4+MnO2+O2↑;
实验时应在试管口放一团棉花,其作用是防止高锰酸钾进入导管.
故填:2KMnO4
K2MnO4+MnO2+O2↑;防止高锰酸钾进入导管.
(2)碳酸钙和稀盐酸反应不需要加热,应该用B装置作为发生装置;
二氧化碳能够溶于水,不能用排水法收集,密度比空气大,可以用向上排空气法收集,即用D装置收集;
反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑.
故填:BD;CaCO3+2HCl═CaCl2+H2O+CO2↑.
(3)实验室常用加热NH4Cl和Ca(OH)2固体混合物的方法制取氨气(NH3),则制取氨气的发生装置应选用A装置;
收集氨的装置只能用E,由此可知氨气应具有的性质是密度比空气小,易溶于水.
故填:A;密度比空气小,易溶于水.
(4)①将含水蒸气的氢气干燥后还原氧化铜,则该气体先要通过装置b,因为b中的浓硫酸能够吸收水.
故填:b.
②如果验证混合气体中有H2、CO和H2O,则混合气体先通过a装置,如果装置中的白色固体变蓝色,说明含有水;
再通过e装置,再通过a装置,如果装置中的白色固体变蓝色,说明产物中含有水,进一步说明原混合气体中含有氢气;
再通过d装置,如果澄清石灰水变浑浊,说明产物中含有二氧化碳,进一步说明原混合气体中含有一氧化碳.
故填:a1→e→a2→d.
| ||
实验时应在试管口放一团棉花,其作用是防止高锰酸钾进入导管.
故填:2KMnO4
| ||
(2)碳酸钙和稀盐酸反应不需要加热,应该用B装置作为发生装置;
二氧化碳能够溶于水,不能用排水法收集,密度比空气大,可以用向上排空气法收集,即用D装置收集;
反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑.
故填:BD;CaCO3+2HCl═CaCl2+H2O+CO2↑.
(3)实验室常用加热NH4Cl和Ca(OH)2固体混合物的方法制取氨气(NH3),则制取氨气的发生装置应选用A装置;
收集氨的装置只能用E,由此可知氨气应具有的性质是密度比空气小,易溶于水.
故填:A;密度比空气小,易溶于水.
(4)①将含水蒸气的氢气干燥后还原氧化铜,则该气体先要通过装置b,因为b中的浓硫酸能够吸收水.
故填:b.
②如果验证混合气体中有H2、CO和H2O,则混合气体先通过a装置,如果装置中的白色固体变蓝色,说明含有水;
再通过e装置,再通过a装置,如果装置中的白色固体变蓝色,说明产物中含有水,进一步说明原混合气体中含有氢气;
再通过d装置,如果澄清石灰水变浑浊,说明产物中含有二氧化碳,进一步说明原混合气体中含有一氧化碳.
故填:a1→e→a2→d.
点评:合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
相关题目
化学实验既要操作规范,更要保障安全.下列实验基本操作符合这一要求的是( )
A、 给液体加热 |
B、 倾倒液体 |
C、 熄灭酒精灯 |
D、 滴加液体 |
煤燃烧产生的废气中含有SO2,用NaOH、Na2SO3溶液可将90%以上的SO2吸收.涉及的反应有
①2NaOH+SO2═Na2SO3+H2O ②Na2SO3+SO2+H2O═2NaHSO3 ③NaHSO3+NaOH═Na2SO3+H2O
下列说法中,不正确的是( )
①2NaOH+SO2═Na2SO3+H2O ②Na2SO3+SO2+H2O═2NaHSO3 ③NaHSO3+NaOH═Na2SO3+H2O
下列说法中,不正确的是( )
| A、反应②是化合反应 |
| B、可循环使用的物质是Na2SO3 |
| C、NaHSO3中硫元素的化合价是+6 |
| D、煤脱硫后燃烧可防止煤燃烧产生SO2 |
 如图所示,在小烧杯乙和丙内分别放入不同的物质后,立即用大烧杯甲罩住小烧杯乙和丙.下列有关实验现象补充完整.
如图所示,在小烧杯乙和丙内分别放入不同的物质后,立即用大烧杯甲罩住小烧杯乙和丙.下列有关实验现象补充完整.