题目内容
【题目】高锰酸钾在生产、生活中有广泛应用。实验小组对高锰酸钾的腐蚀性进行研究。
(查阅资料)KMnO4溶液呈中性,有腐蚀性。
(进行实验)
实验1:将新鲜鸡皮在不同浓度的KMnO4溶液中浸泡相同时间,现象如下表。
KMnO4溶液浓度 | 0.002% | 0.01% | 0.1% | 1% |
鸡皮的变化 | 无明显变化 | 边缘部分变为棕黄色 | 全部变为棕色 | 全部变为黑色 |
实验2:将几种物质在0.1%的高锰酸钾溶液中浸泡相同时间,现象如下表。
物质 | 铁 | 铜 | 硫 | 活性炭 |
现象 | 无明显现象 | 无明显现象 | 有少量刺激性气味气体冒出 | 有无色气体冒出 |
实验3:将铜片分别浸泡在4种溶液中进行实验,所得数据如下表。
编号 | ① | ② | ③ | ④ | |
实验 |
25mL0.1%KMnO4溶液 |
25mL0.1%KMnO4溶液+10滴浓硫酸 |
25mL蒸馏水+10滴浓硫酸 |
25mL1%KMnO4溶液+10滴浓硫 | |
铜片质量/g | 实验前 | 0.54 | 0.54 | a | 0.54 |
18小时后 | 0.54 | 0.52 | 0.54 | 0.43 | |
(解释与结论)
(1)实验1的目的是_____。
(2)下列有关实验2的说法正确的是_____(填序号)。
A 在该实验条件下高锰酸钾溶液对硫的腐蚀比对铜的腐蚀更明显
B 硫被高锰酸钾腐蚀生成的刺激性气味气体可能是SO2
C 铁和铜与高锰酸钾溶液一定不反应
(3)实验2中,活性炭被高锰酸钾腐蚀,产生的气体能使澄清石灰水变浑浊,补全活性炭与高锰酸钾反应的化学方程式。
C+2KMnO4===K2MnO4+MnO2+_____↑
(4)实验3中③,a为_____。
(5)实验3中,通过对比②和④,得出的结论是_____。
(6)实验3中,欲得出“KMnO4和硫酸共同作用对铜才有腐蚀性”的结论,需要对比_____(填编号)。
【答案】探究高锰酸钾溶液浓度与腐蚀性强弱的关系 AB CO2 0.54 在高锰酸钾溶液和浓硫酸等其他条件相同的情况下,高锰酸钾溶液的浓度越大对铜的腐蚀性更强 ①②③
【解析】
(1)实验1的目的是探究高锰酸钾溶液浓度与鸡皮被腐蚀程度的关系。
故填:探究高锰酸钾溶液浓度与鸡皮被腐蚀程度的关系。
(2)A 、由表中现象可知,在该实验条件下高锰酸钾溶液对硫的腐蚀比对铜的腐蚀更明显,正确;
B 硫被高锰酸钾腐蚀生成的刺激性气味气体可能是SO2,正确;
C 没有现象不代表没有发生反应,故错误;
故选:AB。
(3)实验2中,活性炭被高锰酸钾腐蚀,产生的气体能使澄清石灰水变浑浊,说明该气体是二氧化碳,反应的方程式为:C+2KMnO4=K2MnO4+MnO2+ CO2↑,故填:CO2。
(4)根据控制变量法,实验3中③,a为0.54,故填:0.54。
(5)实验3中,通过对比②和④,得出的结论是:在高锰酸钾溶液和浓硫酸等其他条件相同的情况下,高锰酸钾溶液的浓度越大对铜的腐蚀性更强;
故填:在高锰酸钾溶液和浓硫酸等其他条件相同的情况下,高锰酸钾溶液的浓度越大对铜的腐蚀性更强。
(6)①②对比可知,有酸时高锰酸钾溶液对铜有腐蚀作用;②③对比,有高锰酸钾时酸对铜有腐蚀作用。实验3中,欲得出“KMnO4和硫酸共同作用对铜才有腐蚀性”的结论,需要对比①②③;
故填:①②③。

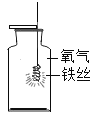
【题目】做完“铁在氧气里燃烧”实验后,小明同学有两个疑惑不解的问题,于是他进行了以下探究活动,请你一同参与.
(问题)铁燃烧时溅落下来的黑色物质中还有没有铁呢?
(查阅资料)(1)自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧化为Fe2O3)
(2)铁的氧化物均能溶于酸的溶液.
(实验探究)将冷却后的黑色物质碾碎,装入试管,加入 ______ 溶液,观察到的现象是 ______,说明铁燃烧时溅落下来的黑色物质中还含有铁.
(问题)铁燃烧的产物为什么不是 Fe2O3呢?
(查阅资料)
(1)Fe3O4和Fe2O3分解温度、铁的熔点见表:
Fe3O4 | Fe2O3 | 铁 | |
分解温度/℃ | 1538 | 1400 |
|
熔点/℃ |
|
| 1535 |
(2)Fe2O3高温时分解成Fe3O4
(理论探讨)根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温应在 ______ 之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产生是Fe3O4.
(拓展研究)
(1)实验中为了防止集气瓶炸裂,必须 ______.
(2)Fe2O3高温时会分解成Fe3O4和一种气体,请写出此反应的化学方程式 ______.
(3)有些超市的食品密封包装盒的透明盖内放有黑色的FeO粉末,若粉末的颜色______,就说明包装盒破损进气,这样售货员就能及时发现并处理.