题目内容
为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止。反应过程中生成的气体与所用硫酸溶液的质量关系如右图所示。试计算:
(1)样品中铜的质量分数;
(2)反应所消耗的硫酸溶液质量;
(3)反应后所得溶液质量。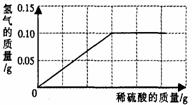
解:设样品中Zn为Xg,反应消耗H2SO4O为Yg ,
Zn + H2SO4=== ZnSO4 + H2↑
65 98 2
X 9.8%Y 0.1g
65/X =98/9.8%Y=2/0.1g
解之得 X=3.25g Y=50g (1) Cu=10g-3.25g=6.75g (2) 50g (3)50g+10g-6.75g-0.1g=53.15g
答:(略)

练习册系列答案
相关题目
某化学兴趣小组为了测定黄铜(铜、锌合金)中锌的质量分数,取出6g合金样品,将50g稀硫酸分5次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
(1)m值为 ;
(2)求合金中锌的质量分数?
(3)求稀硫酸中溶质的质量分数?
| 稀硫酸用量 | 剩余固体质量 |
| 第一次加入10g | 4.7g |
| 第二次加入10g | mg |
| 第三次加入10g | 2.1g |
| 第四次加入10g | 1.2g |
| 第五次加入10g | 1.2g |
(2)求合金中锌的质量分数?
(3)求稀硫酸中溶质的质量分数?
 为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止.反应过程中生成的气体与所用硫酸溶液的质量关系如图所示.试计算:
为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止.反应过程中生成的气体与所用硫酸溶液的质量关系如图所示.试计算: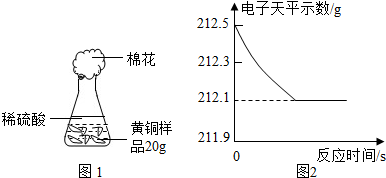
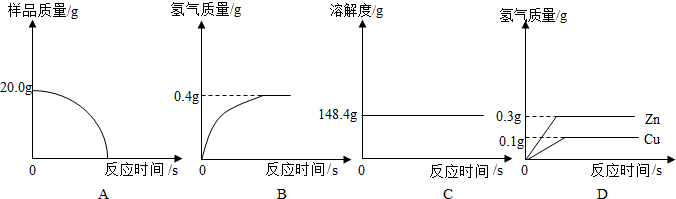
 为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加稀硫酸至刚好不再产生气体为止.反应过程中生成的气体与所用硫酸的质量关系如图所示.根据图示回答问题:
为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加稀硫酸至刚好不再产生气体为止.反应过程中生成的气体与所用硫酸的质量关系如图所示.根据图示回答问题: