题目内容
将铜和氧化铜固体混合物粉末11.2g放入烧杯中,当加入稀硫酸100 g时,氧化铜与硫酸恰好完全反应.过滤后所得溶液的质量为108g,(不考虑过滤过程中溶液的质量损失).
(1)混合物中铜元素的质量分数为 (计算结果保留到0.1%)
(2)求稀硫酸中H2SO4的质量分数.(写出计算过程)
(1)85.7%.(2)9.8%.
解析试题分析:(1)混合物中铜的质量为11.2g+100g﹣108g=3.2g
混合物中氧化铜的质量为
11.2g﹣3.2g=8g
氧化铜中铜元素的质量为
8g×( ×100%)=6.4g
×100%)=6.4g
混合物中铜元素的质量分数为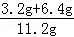 ×100%≈85.7%
×100%≈85.7%
(2)设稀硫酸中溶质的质量分数为x.
CuO+H2SO4=CuSO4+H2O
80 98
8g 100g×x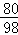 =
=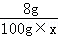 ,x=9.8%
,x=9.8%
答:(1)混合物中铜元素的质量分数为85.7%.
(2)稀硫酸中溶质的质量分数为9.8%.
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.

练习册系列答案
相关题目
化学兴趣小组为了测定石灰石中碳酸钙的质量分数(杂质不溶于水,也不与盐酸反应).测得的数据如下:
| 实验组次 | 1 | 2 | 3 | 4 |
| 样品质量/g | 30 | 20 | 20 | 30 |
| 稀盐酸的质量/g | 50 | 50 | 100 | 100 |
| 产生气体的质量/g | 6.6 | 6.6 | 6.6 | m |
(1)m的值为多少?
(2)第 组实验恰好完全反应?
(3)该石灰石样品的纯度是多少?
 12CO2↑+ 10H2O↑+ 6X↑+ O2↑
12CO2↑+ 10H2O↑+ 6X↑+ O2↑
 2CuSO4 + 2H2O)现有溶质的质量分数为10%的稀硫酸(其中含溶质98 g)与铜恰好完全反应,假设硫酸不和其他杂质反应,求反应后硫酸铜溶液中溶质的质量分数。(最后结果精确到0.1%)
2CuSO4 + 2H2O)现有溶质的质量分数为10%的稀硫酸(其中含溶质98 g)与铜恰好完全反应,假设硫酸不和其他杂质反应,求反应后硫酸铜溶液中溶质的质量分数。(最后结果精确到0.1%)