题目内容
【题目】下列说法正确的是( )
A.依据化学方程式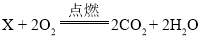 ,可推测x的化学式为C2H4O
,可推测x的化学式为C2H4O
B.中和反应有盐和水生成,则有盐和水生成的反应一定是中和反应
C.CO和CO2虽然元素组成相同,但二者性质不同,原因是分子构成不同
D.探究氧化铜是否为过氧化氢分解的催化剂,只需设计实验证明氧化铜能否改变反应速率即可
【答案】C
【解析】
A. 依据化学方程式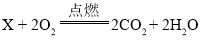 ,根据反应前后原子的种类和质量不变可得,反应前碳原子、氢原子、氧原子的个数分别为0、0、4,反应后碳原子、氢原子、氧原子的个数分别为2、4、6,可推测X中含有2个碳原子和4个氢原子和2个氧原子,所以X的化学式为C2H4O2。故A不符合题意;
,根据反应前后原子的种类和质量不变可得,反应前碳原子、氢原子、氧原子的个数分别为0、0、4,反应后碳原子、氢原子、氧原子的个数分别为2、4、6,可推测X中含有2个碳原子和4个氢原子和2个氧原子,所以X的化学式为C2H4O2。故A不符合题意;
B. 中和反应有盐和水生成,金属氧化物与酸的反应和非金属与碱的反应也都能生成盐和水,所以有盐和水生成的反应不一定是中和反应。故B不符合题意;
C. CO和CO2的元素组成相同,但是它们的分子构成不同,物质的结构决定物质的性质,所以二者性质不同。故C符合题意;
D. 探究氧化铜是否为过氧化氢分解的催化剂,不仅需要设计实验证明氧化铜能否改变反应速率,还要证明反应前后的氧化铜质量和化学性质是否改变。故D不符合题意。
故选C。

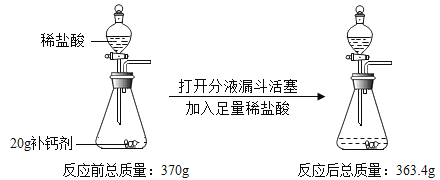
【题目】某同学对“影响稀盐酸和大理石反应快慢的因素”进行探究.选取的药品:成分相同的粉末状大理石、块状大理石两种样品;浓度为16%、9%的稀盐酸.采用控制变量法设计实验方案,以5分钟内收集到CO2的质量作为判断依据.已知稀盐酸足量且样品中杂质不与稀盐酸反应,实验装置如图.读取电子天平的示数,据此计算生成的CO2的质量,记录的数据如表
实验序号 | 大理石 (各6g) | 稀盐酸的浓度 | 反应开始到5分钟产生CO2的质量 | 反应结束产生的CO2的质量 |
① | 块状 | 16% | 2.16g | 2.2g |
② | 块状 | 9% | 1.42g | 2.2g |
③ | 粉末 | 16% | 2.33g | 2.2g |
④ | 粉末 | 9% | 1.93g | m2 |
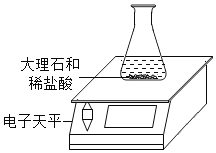
(1)稀盐酸的浓度对该反应快慢的影响:_____.
(2)实验过程中,通过观察如图装置中的哪一现象可判断反应结束_____.
(3)结合表格分析,实验④反应结束后m2的值_____.
(4)探究大理石的颗粒大小对该反应快慢的影响,其实验序号分别是_____.
(5)计算该大理石(6g)样品中含碳酸钙的质量为_____.
【题目】某同学取硫酸钠和硫酸镁固体混合物26.2g,向其中加入219.6g水,使其完全溶解配制成溶液。将200g一定溶质质量分数的氢氧化钠溶液平均分成5等份,依次加入到上述溶液中,生成沉淀的质量与加入氢氧化钠溶液的质量关系如下表:
氢氧化钠溶液加入量/g | 第一次加入40 | 第二次加入40 | 第三次加入40 | 第四次加入40 | 第五次加入40 |
产生沉淀质量/g | 1.45 | 2.9 | m | 5.8 | 5.8 |
计算:(1)m的值为_____。
(2)固体混合物中硫酸镁的质量。
(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数。
【题目】某化学兴趣小组为了测定某石灰石样品中碳酸钙的质量分数,取用2.0g石灰石样品,把25.0g一定质量分数的稀盐酸分五次加入样品中(样品中的杂质既不与盐酸反应,也不溶解于水),每次充分反应后都经过滤、干燥、称量,得实验数据如下:
实验次数 | 1 | 2 | 3 | 4 | 5 |
稀盐酸的累计加入量 | 5.0g | 10.0g | 15.0g | 20.0g | 25.0g |
剩余固体的质量 | 1.5g | 1.0g | 0.5g | 0.2g | X |
(1)表中X的值为 。
(2)样品中碳酸钙的质量分数为 。
(3)求所用稀盐酸的溶质质量分数是多少?