题目内容
【题目】某同学为探究氢氧化钙的性质,进行如下实验。
① 请将实验报告补充完整
实验 步骤 | a | b | c |
|
|
| |
现象 | 溶液变为 (1) 色 | (2) | 有白色沉淀生成 |
结论 | 氢氧化钙溶液能与 酸碱指示剂作用 | 反应的化学方程式是(3) 氢氧化钙能与酸反应 | 氢氧化钙能与 (5) (填物质类别)反应 |
② 向试管b反应后的溶液中逐滴滴加Na2CO3溶液,溶液pH的变化如图所示,请回答。

Ⅰ.m点溶液中的溶质是 (6) 。
Ⅱ.滴入Na2CO3溶液的过程中观察到的现象依次是 (7) 。
Ⅲ.随着碳酸钠溶液的加入,下图中错误的是 (8) 。
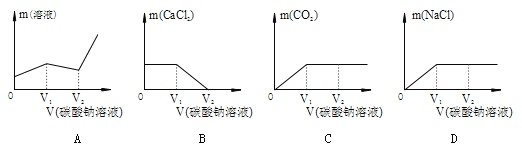
【答案】(1)蓝; (2)溶液由红色变为无色;
(3)Ca(OH)2 + 2HCl![]() CaCl2 + 2H2O; (4)二氧化碳;
CaCl2 + 2H2O; (4)二氧化碳;
(5)酸性氧化物 (6)氯化钙、氯化钠;
(7)先有气泡产生、有白色沉淀产生,溶液由无色变为红色(8)AD
【解析】
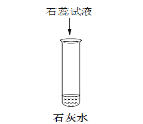
试题分析:(1)氢氧化钙溶液呈碱性,能使紫色石蕊试液变蓝;
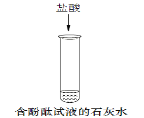
(2)碱性溶液使无色酚酞试液变红,中性或酸性溶液不使酚酞变色,盐酸加入到氢氧化钙溶液中,溶液由碱性变成中性或酸性,所以现象是溶液由红色变为无色;
(3)氢氧化钙能与盐酸反应:Ca(OH)2 + 2HCl![]() CaCl2 + 2H2O;
CaCl2 + 2H2O;
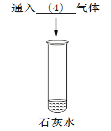
(4)二氧化碳能和氢氧化钙溶液反应生成碳酸钙沉淀;
(5)二氧化碳是酸性氧化物
(6)由反应图像可知,加入碳酸钠之前,b试管中的溶质为氯化钙和氯化氢,加入碳酸钠时,先与氯化氢反应,后与氯化钙反应,m点是碳酸钠和氯化氢刚好完全反应,而氯化钙和碳酸钠的反应还没有进行,所以溶质为原有的氯化钙、生成的氯化钠;
(7)加入碳酸钠时,先与氯化氢反应,后与氯化钙反应,所以现象是先有气泡产生、有白色沉淀产生,当碳酸钠过量后溶液由无色变为红色(8)Na2CO3——CO2 Na2CO3——CaCO3
106 44 106 100
由上述质量关系可知加入的碳酸钠的质量比生成的二氧化碳或碳酸钙质量都大,且还有溶剂水加入,所以溶液的质量不可能减少。A错误。碳酸钠和盐酸及氯化钙反应都生成氯化钠,所以两段反应中氯化钠的质量应该都增加。D错误