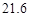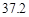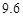题目内容
化学实验老师整理药品时,拿出一瓶久置的氢氧化钙粉末,他让小刘和小赵对这瓶氢氧化钙粉末的组成进行实验探究。
(1)提出问题:这瓶氢氧化钙是否已经生成碳酸钙而变质?
(2)进行猜想:药品可能有以下三种情况。
A.氢氧化钙全部变为碳酸钙;B.氢氧化钙部分变为碳酸钙;C. 。
(3)设计实验方案、进行实验:下表是对猜想A进行实验探究的过程示例:
请你另选择一种猜想参与探究,完成下表。
(4)原理与用途:
①农业上一般采用氢氧化钙改良 性土壤(选填“酸”或“碱”)。
②氢氧化钙变质是由于与空气中的 发生反应的缘故,因此氢氧化钙应 保存。
(1)提出问题:这瓶氢氧化钙是否已经生成碳酸钙而变质?
(2)进行猜想:药品可能有以下三种情况。
A.氢氧化钙全部变为碳酸钙;B.氢氧化钙部分变为碳酸钙;C. 。
(3)设计实验方案、进行实验:下表是对猜想A进行实验探究的过程示例:
| 实验步骤 | 实验现象 | 实验结论 |
| 取样,加适量水,搅拌,过滤 ①取少量滤液于试管中,滴入酚酞试液 ②取少量滤渣于试管中,加入盐酸 | ①滤液不变色 ②有气泡产生 | 氢氧化钙全部变为碳酸钙 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取样,加适量水,搅拌,过滤 ①取少量滤液于试管中,滴入酚酞试液 ②取少量滤渣于试管中,加入盐酸 | ① | |
| ② |
①农业上一般采用氢氧化钙改良 性土壤(选填“酸”或“碱”)。
②氢氧化钙变质是由于与空气中的 发生反应的缘故,因此氢氧化钙应 保存。
(2)没有变质
(3)滤液变红色 ②有气泡产生 氢氧化钙部分变质
(或①滤液变红色 ②无气泡产生 氢氧化钙没有变质)
(4)①酸 ②二氧化碳(CO2) 密封
(3)滤液变红色 ②有气泡产生 氢氧化钙部分变质
(或①滤液变红色 ②无气泡产生 氢氧化钙没有变质)
(4)①酸 ②二氧化碳(CO2) 密封
试题分析:(2)该瓶氢氧化钙在保存期间可能吸收空气二氧化碳而全部变质为碳酸钙,也可能部分吸收二氧化碳而部分变质为碳酸钙,当然,也可能因保存较为完善而未变质。
(3)根据猜想可知,该瓶氢氧化钙还存在另外两种可能:部分变质成碳酸钙和没发生变质;若猜想B成立,即部分变质,也就是说,固体样品中既含有氢氧化钙又有碳酸钙,因此,溶解过滤后,滤液中因含有氢氧化钙,而能使酚酞变红;而滤渣中因含碳酸钙,能与稀盐酸反应放出气体二氧化碳气体;故可观察到:①滤液变红色,②有气泡产生。
若猜想C成立,即未变质,则只有氢氧化钙,因此,溶解过滤后,滤液中因含有氢氧化钙而能使酚酞变红;但滤渣中由于不含碳酸钙,而不能与稀盐酸反应放出气体二氧化碳,故可观察到:①滤液变红色,②无气泡产生。
(4)①由于氢氧化钙呈碱性,能与酸发生中和反应,故农业上一般采用氢氧化钙改良酸性土壤;
②由于氢氧化钙易吸收空气中的二氧化碳,而反应生成碳酸钙沉淀和水而变质,因此氢氧化钙应密封保存,防止接触到空气中二氧化碳。
点评:能熟练判断出氢氧化钙变质的情况是解答本题的关键,对于验证型实验探究,要熟记物质的性质或变化规律,根据给出的实验设计方案,进行实验、分析和探究,并通过观察、记录和分析的实验现象,来验证该物质的性质或变化规律等。

练习册系列答案
相关题目



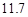 g NaCl和
g NaCl和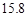 g NH4HCO3,理论上从溶液中析出晶体的质量为 g。
g NH4HCO3,理论上从溶液中析出晶体的质量为 g。