题目内容
【题目】水是生命必需物质,地球表面积的约3/4都被水覆盖。
(1)自然界的水都是____物(填“纯净”或“混合”)。
(2)某校学生进行“水的净化”家庭小实验。
①甲同学用计划纱布将浑浊的泥浆水变澄清,他采用的净水原理相当于实验室的____操作。在实验中他用到了筷子,你觉得筷子的作用是____。
②乙同学用新买的冰箱除臭剂(主要成分是活性炭)来除去水中的颜色和异味,是利用了活性炭的____性。
③丙同学取一壶井水烧开,发现水壶底部有一些固体物质,推测该井水可能是含有较多____和____(填离子符号)的硬水。他可以用____来进一步确定是否为硬水。生活中将水烧开不仅可以降低水的硬度,还可以起到____的作用。
(3)自来水厂常用氯气(Cl2)来消毒,氯气中氯元素的化合价为____。氯气与水反应生成盐酸和具有消毒作用的次氯酸(HClO),该反应的化学式表达式为____。次氯酸与氢氧化钠反应能生成次氯酸钠,次氯酸钠化学式为____。
(4)下图为用三只注射器改装成的实验室电解水的改进装置。实验一段时间后,将B注射器尖端塞子拔掉,用燃着的木条靠近检验气体,看到的现象是____,反应的化学式表达式为____。该实验说明水是由____组成的。

(5)下列有关水的说法错误的是____。
A.地球上水量丰富,不会有缺水危机
B.使用含磷洗衣粉会造成水污染
C.南水北调工程可以缓解水资源分布不均
D.“一水多用”是重要的节水措施
【答案】混合物 过滤 引流 吸附 Ca2+ Mg2+ 肥皂水 杀菌消毒 0 Cl2 + H2O →HClO + HCl NaClO 气体燃烧,产生淡蓝色火焰 H2 + O2 ![]() H2O 氢元素和氧元素 A
H2O 氢元素和氧元素 A
【解析】
(1)混合物是提由多种物质混合而成的物质,自然界中的水因含有多种杂质都为混合物;
(2)①甲同学用计划纱布将浑浊的泥浆水变澄清,他采用的净水原理相当于实验室的过滤操作。在实验中他用到了筷子,你觉得筷子的作用是引流;
②乙同学用新买的冰箱除臭剂(主要成分是活性炭)来除去水中的颜色和异味,是利用了活性炭的吸附性;
③丙同学取一壶井水烧开,发现水壶底部有一些固体物质,推测该井水可能是含有较多Ca2+和Mg2+的硬水。他可以用肥皂水来进一步确定是否为硬水,加入肥皂水后起浮渣、泡沫少是硬水,无浮渣、泡沫多是软水。生活中将水烧开不仅可以降低水的硬度,还可以起到杀菌消毒的作用;
(3)氯气(Cl2)属于单质,单质中元素的化合价为0,故氯气中氯元素的化合价为0。氯气与水反应生成盐酸和次氯酸(HClO),该反应的化学式表达式为:Cl2 + H2O →HClO + HCl。次氯酸钠中钠元素显+1价,次氯酸根显-1价,故次氯酸钠化学式为NaClO;
(4)由图可知,B端连接电源的负极,A端连接电源的正极,电解水实验中正极端产生的气体是氧气,负极端产生的气体是氢气。实验一段时间后,将B注射器尖端塞子拔掉,用燃着的木条靠近检验气体,看到的现象是:气体燃烧,产生淡蓝色火焰;反应的化学式表达式为:H2 + O2![]() H2O;该实验说明水是由氢元素和氧元素组成的;
H2O;该实验说明水是由氢元素和氧元素组成的;
(5)A、地球上水资源丰富,但是可利用的淡水资源不充足,会有缺水危机,选项错误;
B、使用含磷洗衣粉,会造成水的污染,选项正确;
C、南水北调工程可以缓解水资源分布不均,选项正确;
D、“一水多用”是重要的节水措施,选项正确。故选A。

【题目】“化学反应条件的控制是实验灵魂”。小林和同学在老师指导下,探究了“影响过氧化氢分解速度的因素”。
(实验)
(1)取两支大试管,分别倒入适量的5%、10%的过氧化氢溶液,再加入等量的二氧化锰,各收集一集气瓶气体,发现浓度大的先收集满。该操作过程中合理的排列顺序____________。(选填序号)
①检验装置的气密性 ②旋紧连有导管的单孔塞
③将水槽中待收集气体的集气瓶注满水 ④有连续稳定气泡再排水集气
⑤向大试管内倒入适量过氧化氢溶液再加入少许二氧化锰粉末
(2)取a 、b两支试管加入等体积5%的过氧化氢溶液,再分别加入少许二氧化锰粉末、氧化铜(CuO)粉末,发现a 中比b中产生气泡多且快。随即用带火星的木条分别悬空伸入试管内,发现a中火星复燃,b中火星仅发亮但不复燃。
( 结论)
根据实验(1)(2)得出影响过氧化氢溶液分解的因素是________________、_____________。
(反思) “红砖粉末是否也可以作过氧化氢分解的催化剂?”
(实验)实验步骤和现象如下:
①小林分别向两支试管中加入等质量等浓度的过氧化氢溶液,向其中一支试管加入一药匙红砖粉末,然后将两支试管中的气体通入水中比较产生气泡的快慢,发现加入红砖粉末的试管中反应较快。
②将反应较快的试管内固体过滤出来,洗涤、烘干。
③用烘干后的固体重复步骤①的实验,现象与步骤①完全相同。
试回答:步骤③的实验目的是___________________________。小林认为通过上述实验已证明红砖粉末可以作过氧化氢分解反应的催化剂,但老师认为小林同学的实验还缺少一个关键步骤,请指出来_______________________________________。
(拓展提高)
小林在实验时,联想到了卖鱼卖虾的商贩用过氧化钙(CaO2)增加水池中的含氧量,于是提出如下猜想.
(猜想)过氧化钙与水反应可制取氧气.
实验装置 | 实验主要过程 |
| ①检查装置气密性. ②加入过氧化钙和水后,有少量细小气泡缓慢放出,在导管口几乎收集不到气体.该装置放置到第二天,集气瓶中只收集到极少量气体,震荡试管后仍有少量细小气泡缓慢放出. |
实验结论:过氧化钙与水反应____________(填“能”或“不能”)用于实验室制取氧气.
(分析与反思)
(1)过氧化钙与水反应虽然没有快速收集到大量氧气,但由此实验现象,小林认为商贩用过氧化钙做增氧剂的主要原因是______________________.
(2)小林希望对此实验进行改进,使该反应加快,请你帮他提出合理化建议_____________.
(计算)该兴趣小组的同学们购得用于增氧的过氧化钙产品(杂质不含钙元素),标签如图所示.试计算:

(1)过氧化钙的相对分子质量为_____________;
(2)过氧化钙中钙元素与氧元素的质量比为____________;
(3)过氧化钙与水反应生成氢氧化钙和氧气,______g过氧化钙与37g氢氧化钙含钙量相当;
(4)该产品(如图)中过氧化钙的质量分数至少为_____________.
【题目】过氧化氢在生产生活中有广泛应用,实验小组对过氧化氢进行探究。
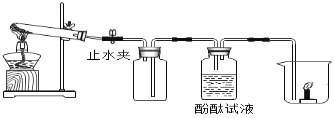
(一)探究过氧化氢制取氧气
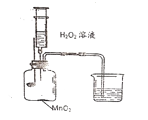
(1)分液漏斗中应放入的物质是_______,锥形瓶中应放入的物质是_______。写出该反应的符号达式__________________________,基本反应类型是_______。
(2)与高锰酸钾加热制取氧气相比,此法优点是_______(填编号)。
① 生成物只有氧气 ② 不需加热 ③ 更环保
(二)微观探究:如图是过氧化氢分解的微观示意图,据图回答:
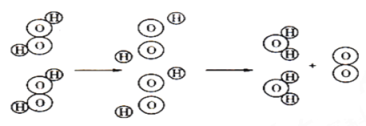
(3)一个过氧化氢分子由__________和____________构成。根据上图可以得出,在化学变化中__________可以再分,而________不能再分。
(三)不稳定性探究:探究温度对过氧化氢分解速率的影响。
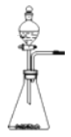
晓晓为了探究温度对H2O2分解速率的影响,利用如图所示装置(夹持装置略去)进行实验(水浴是利用热水进行加热),实验数据如下表:
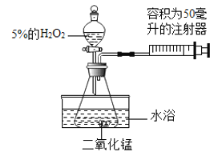
实验1 | 实验2 | |
MnO2的质量/克 | 0.5 | 0.5 |
5%的H2O2的体积/毫升 | 40 | X |
温度/℃ | 20 | 80 |
(4)实验2中X的值应为_______毫升。
(5)实验中可通过___________________________来比较H2O2分解速率的大小。
(6)实验2中水浴温度控制在80℃时,测定的反应速率会比真实值偏大,其原因是_______。
A.锥形瓶内气体受热膨胀 b.收集到的氧气中混有空气
C.温度较高时水蒸发成水蒸气 d.生成更多的氧气
(7)实验结束后若要将MnO2从混合物中分离出来,可采取的方法是_______、洗涤、干燥。