题目内容
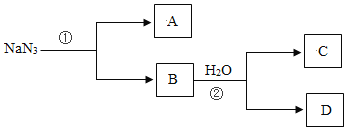
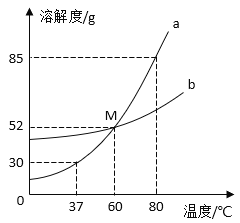
【题目】下图所示的四棱锥体是初中化学常见的六种物质之间的反应关系图。(“→”表示转化关系,“一”表示相互能反应,部分反应物、生成物或反应条件已略去)。X与B发生中和反应,产物之一是厨房内常用的调味品;D常用于改良酸性土壤,且C与D反应可得到B;X、Y是同类物质。请回答:
(1)B的俗称是_____;C的化学式是_____。
(2)写出D→A反应的化学方程式(要求该反应不属于复分解反应)_____。
(3)写出Y→X反应的化学方程式_____。
【答案】烧碱、火碱、苛性钠均可 Na2CO3 ![]() 。
。 ![]()
【解析】
D常用于改良酸性土壤,可推出D为氢氧化钙,X与B发生中和反应,产物之一是厨房内常用的调味品,产物之一应是氯化钠,故X 与B 应是氢氧化钠与盐酸,氢氧化钙与C反应可得到B,故B为氢氧化钠,X为盐酸,氢氧化钙与碳酸钠反应生成碳酸钙和氢氧化钠,故C为碳酸钠,A与氢氧化钙可互相转化,且盐酸、氢氧化钠都能转化为A,可推出A为水,Y能与氢氧化钠、碳酸钠、氢氧化钙反应,且Y能转化为水和盐酸,可推出Y为硫酸,代入验证,符合题意。
(1)由分析可知,B为氢氧化钠,俗称:烧碱、火碱、苛性钠;C为碳酸钠,化学式为:Na2CO3;
(2)D为氢氧化钙,A为水,且要求该反应不属于复分解反应,故D→A可以是氢氧化钙与二氧化碳反应生成碳酸钙和水,该反应不属于基本反应类型,该反应的化学方程式为:![]() ;
;
(3)由分析可知,Y为硫酸,X为盐酸,硫酸可与氯化钡反应生成硫酸钡和盐酸,该反应的化学方程式为:![]() 。
。

 期末集结号系列答案
期末集结号系列答案【题目】某小组同学通过资料发现,向不同浓度的碳酸钠和碳酸氢钠溶液中加入氯化钙溶液,会出现以下现象。继而对氯化钙与两种溶液的反应进行了探究。
Na2CO3 | NaHCO3 | |
现象一 | 产生沉淀 | 产生沉淀和气泡 |
现象二 | 产生沉淀 | 产生沉淀 |
现象三 | 产生沉淀 | 无沉淀 |
(查阅资料)
①![]()
②Ca(HCO3)2易溶于水。
(进行实验)
实验一:70℃恒温水浴下,向10 mL不同浓度的Na2CO3和NaHCO3溶液中滴加10%的CaCl2溶液,现象如下表。
浓度 | Na2CO3 | NaHCO3 |
10% | 滴加1滴出现白色沉淀 | 滴加1滴出现白色沉淀,有较多气泡产生 |
5% | 滴加1滴出现白色沉淀 | 滴加1滴出现白色沉淀,30 s后有少量气泡产生 |
1% | 滴加1滴出现白色沉淀 | 滴加10滴出现浑浊 |
0.5% | 滴加1滴出现白色沉淀 | 滴加52滴出现浑浊 |
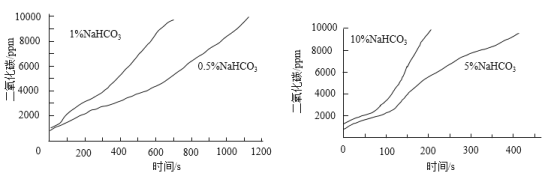
实验二:如图进行实验。70℃恒温水浴下,向10 mL不同浓度的NaHCO3溶液中滴加10%的CaCl2溶液,测得CO2浓度与时间的关系如下图。

(解释与结论)
(1)NaHCO3的俗称是________。
(2)![]() 属于基本反应类型中的________反应。
属于基本反应类型中的________反应。
(3)补全NaHCO3与CaCl2反应的化学方程式:![]() +________+________+H2O。
+________+________+H2O。
(4)实验二得出的结论是________。
(反思与评价)
(5)实验一中,向NaHCO3溶液中滴加CaCl2溶液时,有些只观察到浑浊、未观察到气泡,原因可能是________。
(6)小组同学发现的资料,现象三的NaHCO3溶液中无沉淀,其原因可能为_______。