题目内容
【题目】氯化钙在生活中常用作干燥剂、融雪剂,在工业上可用于制造防冻液等。某工厂以石灰石为原料生产二水合氯化钙(CaCl2·2H2O)流程如下。原料石灰石中含有的杂质主要是MgCO3、SiO2和Fe2O3。
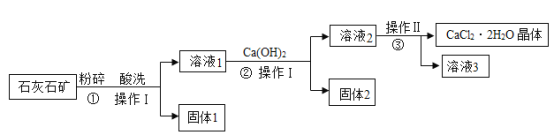
(1)第①步酸洗所用的酸是____________(填编号)。
A 稀盐酸 B 稀硫酸 C 浓硫酸 D 稀硝酸
(2)酸洗时酸与Fe2O3反应的化学方程式是______________。
(3)固体1的名称是__________。
(4)实验室中操作Ⅰ所用到的玻璃仪器有:玻璃棒、烧杯、__________。
(5)操作Ⅱ的名称是:蒸发浓缩、__________、__________。
(6)该流程中可循环利用的物质是__________。
【答案】A ![]() 二氧化硅 漏斗 冷却结晶 过滤 Ca(OH)2
二氧化硅 漏斗 冷却结晶 过滤 Ca(OH)2
【解析】
石灰石粉碎、酸洗后过滤,得到溶液I(CaCl2、MgCl2、FeCl3)和固体I(SiO2),向溶液I中加入氢氧化钙溶液过滤,得到溶液II(CaCl2)和固体II(Mg(OH)2、Fe(OH)3),再经过蒸发浓缩,冷却结晶,过滤即可得到二水合氯化钙。
(1)因为要生产二水合氯化钙,所以选用稀盐酸;
(2)稀盐酸与Fe2O3反应生成氯化铁和水,化学方程式为:![]() ;
;
(3)根据分析可知,固体1是二氧化硅;
(4)操作Ⅰ是过滤,用到的玻璃仪器有:玻璃棒、烧杯、漏斗;
(5)操作Ⅱ的名称是:蒸发浓缩、冷却结晶、过滤;
(6)由流程图可知,该流程中可循环利用的物质是Ca(OH)2。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】某化学活动小组以“酸碱盐的性质”为主题进行探究性学习,请你作为该小组成员一起来解决下列问题:
(1)小丽要测定某地采集到的雨水是否为酸雨,已知pH小于5.6的降水称为酸雨,下列提供的试剂(试纸)中宜取用_______
A 蓝色石蕊试纸 B 紫色石蕊溶液 C 无色酚酞试剂 D pH试纸
(2)小刚探究氢氧化钙的化学性质时分别用澄清石灰水与以下四种物质反应:

I.写出小刚进行的四个实验中无明显现象产生的反应的化学方程式____。
II.若采用另一种盐的溶液取代Na2CO3溶液与澄清石灰水反应,小刚应选择的物质是__。
A BaCl2 B NaCl C FeCl3 D Ba(NO3)2
(3)小雨对碳酸钙高温加热一段时间,得到一些剩余固体。她对这些剩余固体的成分进行了探究。
(提出问题)剩余固体成分是什么?
(猜想与假设)剩余固体成分为:
A 全部是碳酸钙 B 既有碳酸钙,也有氧化钙 C 全部是氧化钙
(设计并完成实验)
实验操作 | 实验现象 | 实验结论 |
a. 取少量固体于试管中,加适量水振荡后静置,再滴几滴无色酚酞试液 | 溶液变红 | 说明固体成分中一定含有__ |
b.再取少量固体于另一试管中滴加过量稀盐酸 | 有气泡生成 | 说明固体成分中一定含有___ |
(实验结论)该化学兴趣小组同学得出的结论:
剩余固体成分与(猜想与假设)中的______ (填“A”“B”或“C”)符合。
(交流与反思)实验操作b产生的气体是_______,如何检验是该气体________;剩余固体的成分若与C相符,则两步操作的实验现象_____(填“a”或“b”或“ab”)不同。