题目内容
【题目】金属材料广泛应用于生产生活中。
(1)常温下大多数金属是固体,但体温计中的金属是液体,该金属是________。用微粒的观点解释利用该金属应于体温的填充剂的原因:___________。
(2)贯休的《读唐史》中“洪炉烹五金,黄金终自奇”从金属的化学性质说明了金的化学性质是__________(填“活泼”或“不活泼”)。
(3)向含有氯化铜、氯化锌、稀盐酸的混合溶液中加入过量铁粉,充分反应后过滤,滤液中含有的溶质是_________(写化学式),试写出其中发生反应的化学方程式____________。
(4)用金属铁制备新型消毒、净水剂K2FeO4的流程图所示:
![]()
①步骤Ⅰ反应的发生反应的基本类型是___________。
②K2FeO4中Fe元素的化合价为_________。
③步骤Ⅱ发生得复分解反应的化学方程式为_________________。
【答案】汞 汞原子受热后微粒间的间隔变大 不活泼 ZnCl2、FeCl2 Fe+2HCl=FeCl2+H2↑和Fe+CuCl2=FeCl2+Cu 置换 +6 FeSO4+2KOH=Fe(OH)2↓+K2SO4
【解析】
(1)大多数金属是固体,常温下是液体的金属是汞。汞可用于体温计的填充剂,原因是原子间有间隔,汞原子受热后微粒间的间隔变大,遇冷间隔变小。
(2)金在金属活动性排在最后,化学性质是不活泼。
(3)锌、铁、铜在金属活动性顺序为锌>铁>氢>铜,向含有氯化铜、氯化锌、稀盐酸的混合溶液中加入过量铁粉,铁能与氯化铜反应生成铜和氯化亚铁,铁能与稀盐酸反应生成氯化亚铁和氢气,但铁不能与氯化锌反应。故滤液中含有的溶质有:末反应的ZnCl2和反应生成的FeCl2,在这过程中发生反应的化学方程式有:Fe+2HCl=FeCl2+H2↑和Fe+CuCl2=FeCl2+Cu。
(4)①步骤Ⅰ反应是铁与硫酸反应,生成硫酸亚铁和氢气,是单质和化合物反应生成单质和化合物,属于置换反应。
②已知K2FeO4中钾元素的化合价为+1价,氧元素的化合价为-2价,设Fe元素的化合价为X,则根据化合物中正负化合价为0,列得:![]() ,解得X=+6。
,解得X=+6。
③步骤Ⅱ发生得复分解反应是硫酸亚铁和氢氧化钾反应,生成氢氧化亚铁沉淀和硫酸钾,反应的化学方程式为FeSO4+2KOH=Fe(OH)2↓+K2SO4。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】下列图像不能正确反映对应变化关系的是
|
|
|
|
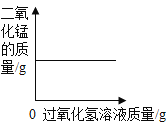
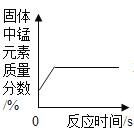
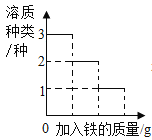
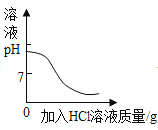
A向一定量的二氧化锰中加入过氧化氢溶液 | B加热一定量的高锰酸钾固体 | C在一定量 AgNO3和 Cu(NO3)2 的混合溶液中加入铁粉 | D向 NaOH 溶液中滴加稀盐酸至过量 |
A.AB.BC.CD.D