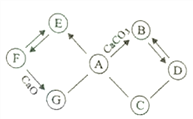
题目内容
【题目】化学上常用燃烧法测定有机物的组成,现取2.3 g某有机物在氧气中充分燃烧生成4.4 g![]() 和2.7 g
和2.7 g![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.该有机物中只含有碳、氢两种元素B.实验中所消耗氧气的质量为4.8g
C.该有机物中碳、氢元素的质量比为6:1D.该有机物可能为乙烯(![]() )
)
【答案】B
【解析】
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和,这个规律叫做质量守恒定律。化学变化中元素的种类、元素质量不发生改变。
思路导析:根据有机物燃烧生成二氧化碳和水可知有机物中一定含有C、H两种元素,利用4.4 g二氧化碳和2.7 g水可求C、H两种元素的质量,若C、H两种元素的质量等于2.3 g,则有机物不含有O元素,若C、H两种元素的质量小于2.3 g,则有机物中含有O元素。
A、C元素的质量为![]() ,H元素的质量为
,H元素的质量为![]() ,
,![]() 。则有机物中一定含有O元素,且O元素的质量为
。则有机物中一定含有O元素,且O元素的质量为![]() ,选项A错误;
,选项A错误;
B、根据质量守恒定律,实验中用去氧气的质量为![]() ,选项B正确;
,选项B正确;
C、该有机物中碳、氢元素的质量比为![]() ,选项C错误;
,选项C错误;
D、该有机物中含有碳、氢、氧三种元素,不可能为乙烯(![]() ),选项D错误。
),选项D错误。
故选B。

 名校通行证有效作业系列答案
名校通行证有效作业系列答案【题目】化学学习小组的同学们在探究氢氧化钠的性质时,将二氧化碳通入盛有氢氧化钠溶液的大试管中,如图所示,结果同学们没有观察到明显现象,于是他们展开了如下探究.新
探究一:二氧化碳是否与氢氧化钠发生了化学反应?
同学们取少量大试管中的液体于另一支试管中,滴加足量的稀盐酸,观察到
证明二氧化碳与氢氧化钠发生了反应.
探究二:反应后大试管中的溶液所含溶质的成分是什么?

【提出猜想】佳佳认为溶质是Na2CO3
贝贝认为溶质是Na2CO3和NaOH
【查阅资料】CaCl2溶液呈中性
【实验验证】贝贝为了验证自己的猜想,进行了如下实验,请你补充完整.
实验操作 | 实验现象 | 实验结论 |
①取一定量大试管中的溶液于试管中,加入足量CaCl2溶液,过滤 ②向滤液滴加适量 | ① ② | 贝贝的猜想成立 |
【实验反思】同学们联想到了氢氧化钠与稀硫酸发生中和反应也观察不到明显现象,为了确定其反应是否反生,有同学设计了如下的实验方案:先用pH试纸测定氢氧化钠溶液的pH,然后向其中滴加稀硫酸,边滴边测定混合溶液的pH,.请你分析上述方案中,为什么要“当测定pH小于或等于7,”才可证明发生反应了,其原因是 .
【题目】甲、乙两同学想了解碳酸钠溶液的酸碱性。他们做了以下研究:
实 验 操 作 | 检测结果 | |
甲同学 | 取pH试纸放在玻璃片上;用玻璃棒蘸取碳酸钠溶液沾在pH试纸上;将试纸显示的颜色与标准比色卡比较。 | pH>7 |
乙同学 | 将pH试纸直接浸入碳酸钠溶液中,把试纸显示的颜色与标准比色卡比较。 | pH>7 |
(1)碳酸钠的化学式为__________,它属于________(填酸、碱、盐、氧化物)
(2)根据两位同学的实验可得出碳酸钠溶液酸碱性的结论:__________________
(3)根据两位同学的实验操作,你认为_________同学操作不规范。为什么?_____________。
(4)如果实验室没有pH试纸,又要一次测定未知溶液的酸碱性,可选用__________试液来进行实验。