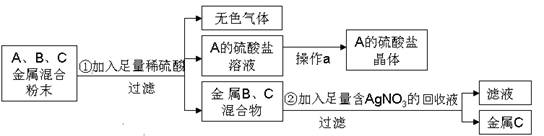
题目内容
硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO、SiO2等)是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁红(氧化铁)等产品的部分流程如下图所示:

(1)硫铁矿是 物(填“纯净”或“混合”)。
(2)写出碳与Fe3O4反应的化学方程式 .
(3)酸浸过滤后滤液中的溶质主要是 。
(4)反应Ⅰ的反应温度一般需控制在35℃以下,其目的是 。
(5)实验探究:产品a的主要成分是K2SO4,试设计实验探究产品a中是否含有氯化物(Cl-)杂质。
实验过程:

(1)硫铁矿是 物(填“纯净”或“混合”)。
(2)写出碳与Fe3O4反应的化学方程式 .
(3)酸浸过滤后滤液中的溶质主要是 。
(4)反应Ⅰ的反应温度一般需控制在35℃以下,其目的是 。
(5)实验探究:产品a的主要成分是K2SO4,试设计实验探究产品a中是否含有氯化物(Cl-)杂质。
实验过程:
| 操 作 | 现 象 | 结 论 |
| ①取产品a的溶液少许,加入 | | 目的是除尽产品中的K2SO4,避免干扰 Cl-的检验 |
| ②过滤,向滤液中加 AgNO3溶液 | | 原样品中含有氯化物(Cl-)杂质 |
混合 (2)2C+Fe3O4高温3Fe+2CO2↑(3)FeSO4(或H2SO4和FeSO4)
(4)防止NH4HCO3分解
(5)
(4)防止NH4HCO3分解
(5)
| 操 作 | 现 象 |
| ①加足量(或过量)Ba(NO3)2溶液 | 产生白色沉淀 |
| ② | 产生白色沉淀 |
试题分析:(1)由题可知,硫铁矿主要成分Fe2O3、Fe3O4、FeO、SiO2等,所以为混合物;(2)碳在高温下和四氧化三铁反应生成铁和二氧化碳;(3)酸浸主要是铁和硫酸反应生成硫酸亚铁和氢气,所以滤液主要成分为硫酸亚铁;(4)反应Ⅰ的反应温度一般需控制在35℃以下,主要是防止温度过高碳酸氢铵分解;实验过程:
| 操 作 | 现 象 |
| ①加足量(或过量)Ba(NO3)2溶液 | 产生白色沉淀 |
| ② | 产生白色沉淀 |
加入过量的硝酸钡溶液,除去硫酸根离子,过滤,然后向滤液中加入硝酸银溶液,如果产生白色沉淀,说明溶液中有氯离子。
点评:此题考察知识点较为陌生,但仔细审题可知考察的思想和基本知识点都是中考要求的基本知识,此题有一定的难度,要多读提,多联系题干。

练习册系列答案
相关题目