题目内容
【题目】下表是 NaOH 和 Ca(OH)2的溶解度数据,请回答下列问题。
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度 (g) | NaOH | 31 | 91 | 111 | 129 | 313 | 336 |
Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
(1)从表中数据可以获得的信息是_____(写一条)。
(2)把 80℃时 NaOH 的饱和溶液降温至 20℃,可以看到的现象是_____;现有 20℃时 Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量 CaO 后得到的溶液(乙溶液),此时溶液的溶质量分数乙___ 甲(填>、<、=),恢复到 20℃时溶液的溶质量分数乙___甲(填>、<、=)。
(3)某兴趣小组对部分变质的氢氧化钠固体进行提纯,设计了如下操作流程:请回答:
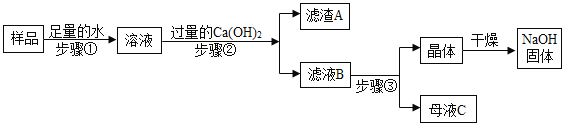
(Ⅰ)步骤②反应的化学方程式为_________; 加入过量 Ca(OH)2的目的是_____。
(Ⅱ)滤液 B 中的溶质是_____和_____(写化学式);步骤③所包含的具体操作是加热 浓缩、_____、过滤。
【答案】NaOH 的溶解度随温度的升高而增大(或 Ca(OH)2的溶解度随温度的升高而减少)(合理即可) 有固体析出 < = Ca(OH)2 + Na2CO3 = CaCO3↓+ 2NaOH 将溶液中的碳酸钠完全转化为氢氧化钠 Ca(OH)2 NaOH 降温结晶
【解析】
(1)根据表格中物质的溶解度与温度的变化关系可知,NaOH的溶解度随温度的升高而增大;Ca(OH)2的溶解度随温度的升高而减少(合理即可);
(2)氢氧化钠的溶解度随温度的降低而减小,所以把80℃时NaOH的饱和溶液降温至20℃,可以看到的现象是:有固体析出;氧化钙和水反应放热,氢氧化钙的溶解度随温度的升高而减小,所以现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液的溶质质量分数乙<甲,恢复至室温后仍为该温度下氢氧化钙的饱和溶液,所以其溶质的质量分数与甲溶液中溶质的质量分数相等;
(3)(I)碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,反应的化学方程式为:Ca(OH)2 + Na2CO3 = CaCO3↓+ 2NaOH;加入过量Ca(OH)2的目的是将溶液中的碳酸钠完全转化为氢氧化钠;
(Ⅱ)因为加入的氢氧化钙溶液是过量的,所以滤液B中的溶质是Ca(OH)2和NaOH,因为氢氧化钠的溶解度受温度影响较大,氢氧化钙的溶解度随温度的降低而增大,所以步骤④所包含的具体操作是加热浓缩、降温结晶、过滤。

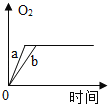
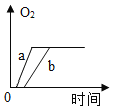
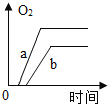
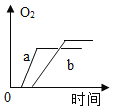
【题目】某兴趣小组用如图所示装置对KClO3的分解的速率进行探究,在相同的加热条件下完成实验,实验记录如表下列有关说法正确的是( )
编号 | KClO3质量 | 其它物质的质量 | 收集50mLO2所需时间 | |
实验一 | 5g | ﹣ | ﹣ | 171s |
实验二 | 5g | MnO2 | 0.5g | 49s |
实验三 | 5g | KMnO4 | 0.5g | 58s |
实验四 | 5g | KCl | 0.5g | 154s |
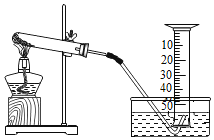
A.该实验收集氧气也可采用向上排空气法
B.实验三和实验一对比说明KMnO4是KClO3分解的催化剂
C.维持加热条件不变,若实验一继续收集50mLO2 ,所需时间仍为171s
D.若都加热至反应完全,实验三产生氧气的质量最大