题目内容
某化学兴趣小组的同学在实验室配制10%的氢氧化钠溶液、5%的盐酸、10%的盐酸三种溶液.(1)配制10%的盐酸的步骤为:①稀释②计算③装瓶并贴标签④量取浓盐酸和水.其正确的顺序为(填序号).
(2)若所配氢氧化钠溶液的质量分数小于10%,则下列可能的原因正确的是.
①量取水时俯视读数;②量取水时仰视读数;③配制所用烧杯未干燥;④称量时指针偏左;⑤倒入固体时有固体洒落在烧杯外
(3)他们忘记了给配制的三瓶溶液贴上标签,想对未贴标签的三瓶溶液进行鉴别.老师只给他们提供了无色酚酞试液、试管和胶头滴管,要求用简便的方法鉴别出三种溶液:
A、用三支小试管取三种试液少许,各加入1-2d酚酞试液,的是氢氧化钠溶液.
B、再取两支试管取等量的氢氧化钠溶液,各加入1-2d酚酞试液,将另外两种溶液分别加入,的是5%的盐酸.
【答案】分析:(1)根据溶液配制的操作顺序分析即可;
(2)根据溶质质量分数概念并结合选项分析即可;
(3)根据酸碱指示剂的特点分析即可.
解答:解:(1)配制10%的盐酸的步骤为:计算、量取浓盐酸和水、稀释、装瓶并贴标签;
故答案为:②④①③;
(2)若所配氢氧化钠溶液的质量分数小于10%,根据溶质质量分数概念分析,可能的原因是溶质减少或溶剂增多,
①量取水时俯视读数会造成溶剂减少,质量分数会大于10%,故错误;
②量取水时仰视读数可造成溶剂增多,质量分数会小于10%,故正确;
③配制所用烧杯有水会导致加入的水偏多,会造成小于10%.如果是称量氢氧化钠所用烧杯不干燥,就造成称得的固体小于需要的数值,也会小于10%.正确;
④称量时指针偏左会造成溶质增加,质量分数会增大,故错误;
⑤倒入固体时有固体洒落在烧杯外会造成溶质减少,质量分数会小于10%,故正确;
故答案为:②③⑤.
(3)A、酚酞在酸性和中性环境中无色,在碱性环境中显红色;所以显红色的为氢氧化钠;
B、两支试管取等量的氢氧化钠溶液,各加入1-2d酚酞试液,再将将另外两种溶液分别加入,若为10%盐酸,溶液为中性,无色;
若为5%盐酸,溶液依然为碱性,显红色;
故答案为:显红色、溶液颜色不变的.
点评:用量筒量取液体时,若俯视读数会造成所量液体体积比实际值小,若仰视读数会造成所量液体体积比实际值大,
正确读数方法为:视线与量筒内液体的凹液面的最低处保持水平.
(2)根据溶质质量分数概念并结合选项分析即可;
(3)根据酸碱指示剂的特点分析即可.
解答:解:(1)配制10%的盐酸的步骤为:计算、量取浓盐酸和水、稀释、装瓶并贴标签;
故答案为:②④①③;
(2)若所配氢氧化钠溶液的质量分数小于10%,根据溶质质量分数概念分析,可能的原因是溶质减少或溶剂增多,
①量取水时俯视读数会造成溶剂减少,质量分数会大于10%,故错误;
②量取水时仰视读数可造成溶剂增多,质量分数会小于10%,故正确;
③配制所用烧杯有水会导致加入的水偏多,会造成小于10%.如果是称量氢氧化钠所用烧杯不干燥,就造成称得的固体小于需要的数值,也会小于10%.正确;
④称量时指针偏左会造成溶质增加,质量分数会增大,故错误;
⑤倒入固体时有固体洒落在烧杯外会造成溶质减少,质量分数会小于10%,故正确;
故答案为:②③⑤.
(3)A、酚酞在酸性和中性环境中无色,在碱性环境中显红色;所以显红色的为氢氧化钠;
B、两支试管取等量的氢氧化钠溶液,各加入1-2d酚酞试液,再将将另外两种溶液分别加入,若为10%盐酸,溶液为中性,无色;
若为5%盐酸,溶液依然为碱性,显红色;
故答案为:显红色、溶液颜色不变的.
点评:用量筒量取液体时,若俯视读数会造成所量液体体积比实际值小,若仰视读数会造成所量液体体积比实际值大,
正确读数方法为:视线与量筒内液体的凹液面的最低处保持水平.

练习册系列答案
相关题目
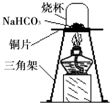 12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.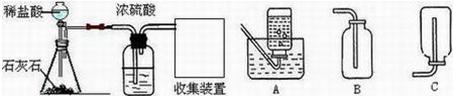
 (2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹.
(2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹. 某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.