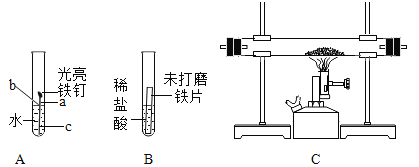
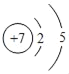题目内容
【题目】自来水厂净水过程的主要操作流程如图.
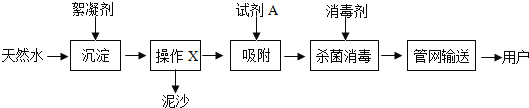
资料:常用的絮凝剂有明矾[KAl(SO4)12H2O],消毒剂有液氯(Cl2)
回答下列问题:
(1)操作X的名称是____,试剂A的名称是____。
(2)明矾作絮凝剂是因为与水反应生成氢氧化铝胶状物.氢氧化铝的化学式为____.液氯与水中杂质反应生成一些对人体有害的物质,例如三氯甲烷(CHCl3).三氯甲烷属于____(填“有机物”或“无机物”)
(3)高铁酸钾(K2FeO4)能作消毒剂与絮凝剂.它杀菌时会生成氢氧化铁胶状物.高铁酸钾中铁元素的化合价是____.
(4)自来水厂的净水过程____(填“能”或“不能”)将硬水软化成软水.生活中将硬水软化的方法是____,经过此法后,水中的部分Ca2+、Mg2+转化为沉淀,即通常所说的水垢,水垢的主要成分为____.
(5)自来水中通常都含有Cl﹣,可以在水样中滴加少量稀硝酸和____检验,若出现____现象,说明水中含有Cl﹣.
(6)实验室用自来水制取蒸馏水的蒸馏烧瓶里,通常要加入几粒沸石或碎瓷片,作用是____
(7)电解氢氧化钠稀溶液与电解水的原理均可表示为:2H2O![]() 2H2↑+O2↑。电解一定质量氢氧化钠稀溶液的过程中,下列说法正确的是_____
2H2↑+O2↑。电解一定质量氢氧化钠稀溶液的过程中,下列说法正确的是_____
A 溶液中钠元素质量变大 B 溶液中氢、氧元素质量比不变
C 溶液中氢元素质量分数减小 D 溶液的pH减小
【答案】过滤 活性炭 Al(OH)3 有机物 +6价 不能 煮沸 碳酸钙和氢氧化镁 硝酸银溶液 白色沉淀 防止暴沸 C
【解析】
(1)由自来水厂净水过程的主要操作流程可知,操作X能将固液分离,名称是过滤,由于活性炭具有吸附性,试剂A的名称是活性炭;
(2)氢氧化铝的化学式为:Al(OH)3,三氯甲烷(CHCl3)是含有碳元素的化合物,属于有机物;
(3)高铁酸钾(K2FeO4)中,钾元素显+1价,氧元素显-2价,设:高铁酸钾(K2FeO4)中铁的化合价为x,根据化合物中各元素化合价的代数和为零,则有:(+1)×2+x+(-2)×4=0.解得x=+6;
(4)自来水厂的净水过程不能除去可溶性的钙、镁离子,不能将硬水软化成软水;天然水煮沸时,水中可溶性钙、镁化合物转化为沉淀,水的硬度降低,生活中将硬水软化的方法是煮沸;经过此法后,水中的部分Ca2+、Mg2+转化为沉淀,即通常所说的水垢,水垢的主要成分为CaCO3、Mg(OH)2;
(5)氯离子与银离子结合生成不溶于稀硝酸的白色沉淀。自来水中通常都含有Cl-,可以在水样中滴加少量稀硝酸和硝酸银检验,若出现白色沉淀现象,说明水中含有Cl-;
(6)实验室用自来水制取蒸馏水的蒸馏烧瓶里,通常要加入几粒沸石或碎瓷片,作用是防止暴沸;
(7)A 根据质量守恒定律,钠元素质量不变,故A错误;
B 氢氧化钠中氢、氧元素质量比1:16,水中氢、氧元素质量比为1:8,因此水电解后溶液中氢、氧元素质量比改变,故B错误;
C 水电解出氢气,所以溶液中氢元素质量减小,氢元素质量分数减小,故C正确;
D 电解氢氧化钠稀溶液,水电解为氢气和氧气,质量减少,碱性增强,溶液的pH增大,故D错误。故选C。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】图表法是一种常用的数据处理方法,也是化学学习的重要工具。请结合所给图表回答问题。
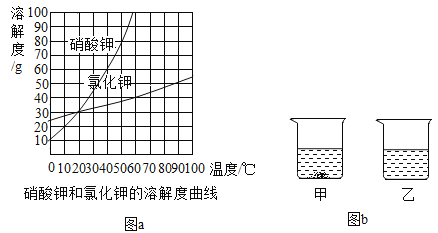
(1)图a是硝酸钾和氯化钾的溶解度曲线。25℃将等质量的氯化钾和硝酸钾分别加入到各盛有 100g 水的两个烧杯中,充分搅拌后得无色溶液,降温至 15℃时 出现如图 b 所示现象。烧杯甲中溶解的溶质是________________________(填化学式)。 硝酸钾中含有少量氯化钾,应采用____________的方法提纯硝酸钾。
(2)如图数轴中 A、B、C 处表示的是常温时将氯化钠、硝酸铵、烧碱三种物质 分别溶于 100g 水所得溶液的温度,其中表示硝酸铵的是__________填序号)。

(3)如图是氢氧化钠和碳酸钠在不同温度不同溶剂中的溶解度表。
溶质 溶解度 溶剂 | 氢氧化钠 | 碳酸钠 | ||
20℃ | 40℃ | 20℃ | 40℃ | |
水 | 109g | 129g | 21.8g | 49g |
酒精 | 17.3g | 40g | 不溶 | 不溶 |
20℃时,若将 0.8g 氢氧化钠分别投5g 酒精的大试管中,振荡,再向 其中通入 CO2,观察到的实验现象为__________________,反应方程式为__________________________。