题目内容
【题目】某活动小组探究某种塑料袋中碳元素的质量分数,装置如下图所示:
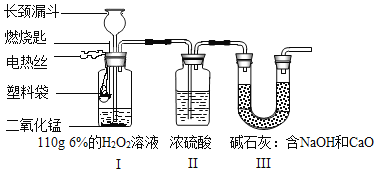
已知:①H2O2溶液分解放出的氧气在逸出时会带出少量水蒸气。
②碱石灰的作用是吸收CO2。
③忽略空气对本实验的影响。
实验步骤如下:
(1)检查装置气密性。
(2)称量塑料袋的质量是w克。
(3)用30%的H2O2溶液(密度为1.1g/mL)配制110g6%的H2O2溶液。
①需要30%的H2O2溶液_____g。
②配制时除了要使用200mL烧杯、100mL量筒和20mL量筒外,还需要的玻璃仪器有_____。
(4)进行实验和收集数据。
按图所示连接好实验装置,从装置I中的长颈漏斗中加入110g6%的H2O2溶液,通过电热丝点燃塑料袋。待塑料袋燃烧完,冷却后,装置Ⅲ实验后的质量比实验前增加了a克。则塑料中碳元素的质量分数是_____。(用含a和w的式子表示)
(5)实验分析。
①装置Ⅱ的作用是_____;
②实验中H2O2溶液需过量,其作用除了能防止装置Ⅱ中的液体倒吸外,还有_____。
【答案】22 玻璃棒和滴管 ![]() % 吸收水蒸气 产生充足的O2供塑料袋完全燃烧,将塑料袋燃烧生成的CO2全部排出被碱石灰吸收
% 吸收水蒸气 产生充足的O2供塑料袋完全燃烧,将塑料袋燃烧生成的CO2全部排出被碱石灰吸收
【解析】
(3)①设需要30%的H2O2溶液质量为x,110g×6%=x×30%,解得:x=22g;
②配制时除了要使用200mL烧杯、100 mL量筒和20 mL量筒外,还需要的玻璃仪器有玻璃棒和滴管。
(4)装置Ⅲ实验后的质量比实验前增加了ag,说明塑料燃烧生成了ag二氧化碳,塑料中碳元素质量:ag×![]() =
=![]() ag,
ag,
则塑料中碳元素的质量分数是:![]() ×100%=
×100%=![]() %,
%,
(5)实验
①装置Ⅱ的作用是吸收水蒸气。
②实验中H2O2溶液需过量,其作用除了能防止装置Ⅱ中的液体倒吸外,还有产生充足的O2供塑料袋完全燃烧,将塑料袋燃烧生成的CO2全部排出被碱石灰吸收。

【题目】常见的盐的组成填表:
名称 | 化学式 | 阴离子 | 阳离子 |
氯化钠 | _____ | _____ | _____ |
碳酸钠 | _____ | _____ | _____ |
碳酸氢钠 | _____ | _____ | _____ |
碳酸钙 | _____ | _____ | _____ |
硫酸铜 | _____ | _____ | _____ |