题目内容
【题目】5分)镁是一种用途很广的金属,目前世界上60%的镁是从海水(主要含NaCl和MgCl2等)中提取的。主要步骤如下:
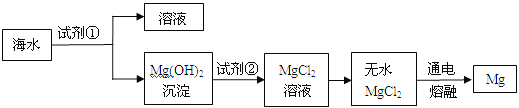
(1)上述步骤中试剂①应过量,理由是 。
(2)请写出Mg(OH)2沉淀与试剂②发生中和反应的化学方程式 。
(3)无水MgCl2在熔融状态下通电得到金属镁和物质A,氢气在物质A中燃烧生成物质B,则物质A和B的化学式分别为:A ,B 。
【答案】(1)使MgCl2完全转化为沉淀 (2)Mg(OH)2 + 2HCl = MgCl2 + 2H2O
(3)Cl2 HCl
【解析】
试题分析:(1)步骤中试剂①的目的是将MgCl2转化为沉淀,应加过量理由是:使MgCl2完全转化为沉淀 (2)中和反应是酸和碱作用生成盐和水,故Mg(OH)2沉淀与试剂②发生中和反应,说明所加试剂为稀盐酸,化学方程式:Mg(OH)2 + 2HCl = MgCl2 + 2H2O
(3)根据质量守恒定律,化学反应前后,元素的种类不变,故无水MgCl2在熔融状态下通电得到金属镁和物质A,,可推断物质A应为氯气,化学式为Cl2;氢气在氯气中燃烧生成物质氯化氢,化学式为: HCl

练习册系列答案
相关题目