题目内容
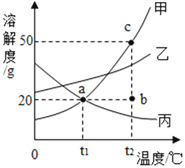
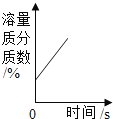
【题目】t1°C时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图所示,硝酸钾和氯化钾的溶解度曲线如图所示.
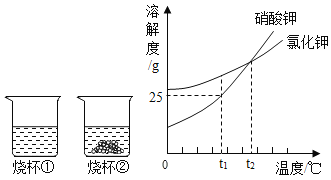
(1)烧杯②种的上层清液是否达到饱和状态?__________(填“是”“否”或“无法判断”);
(2)烧杯①中溶解的溶质是________(写化学式);
(3)将t1°C时125g硝酸钾的饱和溶液稀释成10%的溶液,需加水_______g;
(4)关于图中烧杯内的物质,下列说法正确的是_______。
A 烧杯①内溶液中溶质的质量分数>烧杯②内上层清液中溶质的质量分数
B 蒸发一定量的水,两烧杯中都一定有固体析出
C 将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体
D 将温度升高到t2°C,两烧杯内溶液中溶质的质量分数相等(不考虑水的蒸发)
【答案】是 KCl 125 A D
【解析】
(1)烧杯②中有固体剩余,所以上层清液是达到饱和状态;
(2)t1℃时,氯化钾的溶解度大于硝酸钾的溶解度,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,烧杯②中有固体剩余,所以烧杯①中溶解的溶质是氯化钾;
(3)将t1℃时硝酸钾的饱和溶液100g稀释成10%的溶液,需加水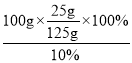 -125g=125g;
-125g=125g;
(4)A、t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,烧杯②中有固体剩余,所以烧杯①内溶液中溶质的质量分数>烧杯②内上层清液中溶质的质量分数,故正确;
B、蒸发一定量的水,烧杯②中都一定有固体析出,烧杯①中不一定有固体析出,故错误;
C、将两个烧杯中的溶液混合,溶剂质量扩大一倍,充分搅拌后,烧杯中不一定还有剩余的固体,故错误;
D、将温度升高到t2℃,溶解度相等,固体全部溶解,所以两烧杯内溶液中溶质的质量分数相等,故正确。
故选AD。

 轻松暑假总复习系列答案
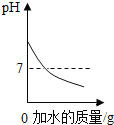
轻松暑假总复习系列答案【题目】烧杯中盛有x溶液,逐滴加入(或通入)y物质,烧杯内液体的pH变化如图所示。则符合该变化的一组物质是( )
x | y | |
A | NaOH溶液 | 稀HCl(过量) |
B | Ca(OH)2 | CO2(适量) |
C | 稀H2SO4 | Ba(NO3)2溶液 |
D | 稀HCl | H2O |
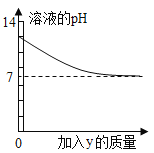
A.AB.BC.CD.D
【题目】小明同学在一次实验中将氯化钠溶液加入到稀硫酸(H2SO4) 中没有观察到明显现象,而将混合溶液加热一段时间后,意外地闻到刺激性气味。
[提出问题]有刺激性气味的气体是什么?
[猜想与假设]猜想1:可能是二氧化硫;
猜想2:可能是氯化氢;
猜想3:可能是氨气。依据质量守恒定律,可判断猜想_____________不合理。
[查阅资料]①SO2和CO2的化学性质相似,都能使澄清石灰水变浑浊,氯化氢不能使澄清石灰水变浑浊;②SO2、CO2 和HCI的水溶液都显酸性,石蕊遇到酸性溶液变红。
(1)写出二氧化碳与石灰水反应的化学方程式_________________。
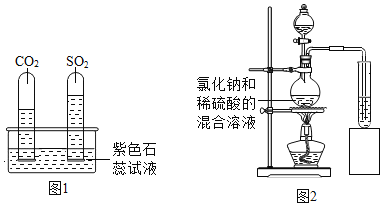
(2)如图1,将两支大小相同的收集满SO2和CO2的试管同时倒立于水槽中,一段时间后, 实验现象如图所示,说明在相同条件下的溶解性:SO2______________________(填“>”或“<”) CO2。
[实验探究]如图2,小明将产生的气体通入紫色石蕊溶液中,观察到______________,于是他认为猜想2正确。小丽认为小明的结论不科学,原因是_____________。
[实验改进]请你利用提供的试剂,设计实验确认猜想2正确。
试剂:稀硫酸、澄清石灰水、氯化钠溶液、硫酸铜溶液、紫色石蕊溶液。
实验操作 | 实验现象 | 结论 |
如图,将产生的气体_______________ | ______________ | 猜想2成立 |
[拓展应用]实验室可用氯化钠和硫酸反应制取氯化氢气体,已知氯化氢气体极易溶于水,请推测实验室制取氯化氢气体最适宜的方法为___________(填字母)
A加热氯化钠溶液和稀硫酸的混合物
B加热氯化钠固体和稀硫酸的混合物
C加热氯化钠固体和浓硫酸的混合物