题目内容
某化学兴趣小组的同学利用下图实验装置进行实验室制取气体的探究.
请你参与探究,并回答下列问题:
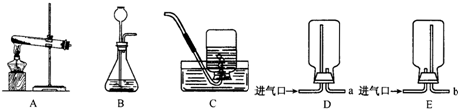
(1)写出指定仪器的名称①
(2)以高锰酸钾为原料实验室制取氧气,应选用的装置组合为
(3)检查装置C的气密性的一种方法:
(4)若用如图G装置作为排空气法收集氧气,氧气由
(5)通过查阅资料得知:氨气是一种密度比空气小且极易溶于水的气体,其水溶液称为氨水.小芳同学加热氯化铵和氢氧化钙的固体混合物制取氨气,她应选择的反应的发生装置是
(6)某同学探究了影响双氧水分解速度的某种因素.实验数据记录如下:
本实验中,测量O2体积的装置是

实验结论:在相同条件下,
丙用图f装置进行实验,通过比较

请你参与探究,并回答下列问题:
(1)写出指定仪器的名称①
试管
试管
;②集气瓶
集气瓶
.(2)以高锰酸钾为原料实验室制取氧气,应选用的装置组合为
BD或BF
BD或BF
,反应的符号表达式为2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
.
| ||
(3)检查装置C的气密性的一种方法:
加水形成液封,先把导管的一端放人水中,然后两手紧握锥形瓶的外壁,观察导管口是否有气泡冒出
加水形成液封,先把导管的一端放人水中,然后两手紧握锥形瓶的外壁,观察导管口是否有气泡冒出
(4)若用如图G装置作为排空气法收集氧气,氧气由
a
a
口进入.(5)通过查阅资料得知:氨气是一种密度比空气小且极易溶于水的气体,其水溶液称为氨水.小芳同学加热氯化铵和氢氧化钙的固体混合物制取氨气,她应选择的反应的发生装置是
B
B
,收集装置是E
E
.(填编号)小芳将收集满氨气的试管倒扣在盛有无色酚酞的水中如图e,观察到的现象是试管内液面上升,溶液由无色变为红色
试管内液面上升,溶液由无色变为红色
.(6)某同学探究了影响双氧水分解速度的某种因素.实验数据记录如下:
| 双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2体积 | |
| Ⅰ | 50.0g | 1% | 0.1g | 9mL |
| Ⅱ | 50.0g | 2% | 0.1g | 16mL |
| Ⅲ | 50.0g | 4% | 0.1g | 31mL |
c
c
(填编号).
实验结论:在相同条件下,
过氧化氢的浓度越大
过氧化氢的浓度越大
,双氧水分解得越快.丙用图f装置进行实验,通过比较
总质量减少的快慢
总质量减少的快慢
也能达到实验目的.分析:制取装置包括加热和不需加热两种,如果用双氧水制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.检查装置C的气密性的一种方法是:加水形成液封,先把导管的一端放人水中,然后两手紧握锥形瓶的外壁,观察导管口是否有气泡冒出;若用如图G装置作为排空气法收集氧气,氧气由a进入,因为氧气的密度比空气的密度大;氨气是一种密度比空气小且极易溶于水的气体,因此氨气只能用向下排空气法收集;加热氯化铵和氢氧化钙的固体混合物制取氨气,因此需要加热;小芳将收集满氨气的试管倒扣在盛有无色酚酞的水中如图e,观察到的现象是:试管内液面上升,溶液由无色变为红色;某同学探究了影响双氧水分解速度的某种因素,应该用c测氧气的体积;根据表格数据可知:在相同条件下,过氧化氢的浓度越大,双氧水分解得越快;丙用图f装置进行实验,通过比较总质量减少的快慢也能达到实验目的.
解答:解:(1)试管常用的反应容器,集气瓶常用的收集仪器,故答案为:试管;集气瓶
(2)如果用高锰酸钾制氧气就需要加热,氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.故答案为:BD或BF;2KMnO4
K2MnO4+MnO2+O2↑;
(3)检查装置C的气密性的一种方法是:加水形成液封,先把导管的一端放人水中,然后两手紧握锥形瓶的外壁,观察导管口是否有气泡冒出;故答案为:加水形成液封,先把导管的一端放人水中,然后两手紧握锥形瓶的外壁,观察导管口是否有气泡冒出
(4)若用如图G装置作为排空气法收集氧气,氧气由a进入,因为氧气的密度比空气的密度大;故答案为:a
(5)氨气是一种密度比空气小且极易溶于水的气体,因此氨气只能用向下排空气法收集;加热氯化铵和氢氧化钙的固体混合物制取氨气,因此需要加热;小芳将收集满氨气的试管倒扣在盛有无色酚酞的水中如图e,观察到的现象是:试管内液面上升,溶液由无色变为红色;故答案为:B;E;试管内液面上升,溶液由无色变为红色
(6)某同学探究了影响双氧水分解速度的某种因素,应该用c测氧气的体积;根据表格数据可知:在相同条件下,过氧化氢的浓度越大,双氧水分解得越快;丙用图f装置进行实验,通过比较总质量减少的快慢也能达到实验目的,故答案为:总质量减少的快慢
(2)如果用高锰酸钾制氧气就需要加热,氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.故答案为:BD或BF;2KMnO4
| ||
(3)检查装置C的气密性的一种方法是:加水形成液封,先把导管的一端放人水中,然后两手紧握锥形瓶的外壁,观察导管口是否有气泡冒出;故答案为:加水形成液封,先把导管的一端放人水中,然后两手紧握锥形瓶的外壁,观察导管口是否有气泡冒出
(4)若用如图G装置作为排空气法收集氧气,氧气由a进入,因为氧气的密度比空气的密度大;故答案为:a
(5)氨气是一种密度比空气小且极易溶于水的气体,因此氨气只能用向下排空气法收集;加热氯化铵和氢氧化钙的固体混合物制取氨气,因此需要加热;小芳将收集满氨气的试管倒扣在盛有无色酚酞的水中如图e,观察到的现象是:试管内液面上升,溶液由无色变为红色;故答案为:B;E;试管内液面上升,溶液由无色变为红色
(6)某同学探究了影响双氧水分解速度的某种因素,应该用c测氧气的体积;根据表格数据可知:在相同条件下,过氧化氢的浓度越大,双氧水分解得越快;丙用图f装置进行实验,通过比较总质量减少的快慢也能达到实验目的,故答案为:总质量减少的快慢
点评:本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和反应速度与浓度的关系等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
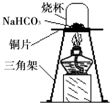 12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.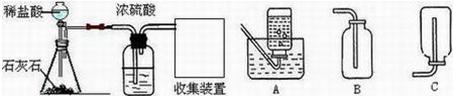
 (2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹.
(2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹. 某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.