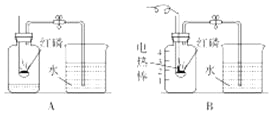
题目内容
【题目】某兴趣小组同学通过实验测定泰山大理石中碳酸钙的含量。将一定量的大理石放入烧杯中,加入100g稀盐酸,恰好完全反应,生成的气体质量如图所示,计算:
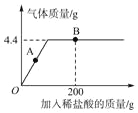
(1)生成的二氧化碳的质量_____g。
(2)A点时,溶液中的溶质有_____。
(3)稀盐酸中溶质的质量分数____( 写出计算过程)。
(4)B点时,溶液中生成物的质量是_____g。
【答案】4.4 氯化钙 7.3% 11.1
【解析】
(1)生成的二氧化碳的质量是4.4g。
故填:4.4。
(2)A点时,溶液中的溶质有碳酸钙和稀盐酸反应生成的氯化钙。
故填:氯化钙。
(3)设100g稀盐酸中溶质的质量为x,反应生成氯化钙质量为y,
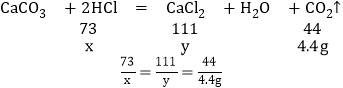
x=7.3g,y=11.1g,
稀盐酸中溶质的质量分数为:![]() ×100%=7.3%,
×100%=7.3%,
答:稀盐酸中溶质的质量分数是7.3%。
(4)B点时,溶液中生成物氯化钙的质量是11.1g,
故填:11.1。

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目