题目内容
【题目】硝酸钾、氯化钾的溶解度曲线如图1所示。
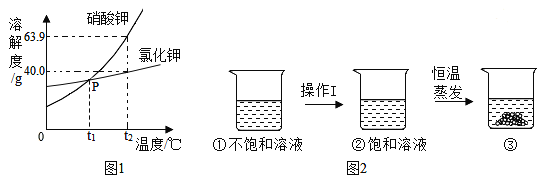
(1)P点的含义是_____。
(2)当温度_____℃时,硝酸钾的溶解度小于氯化钾的溶解度。
(3)t2℃时,分别将30g硝酸钾和氯化钾加入到50g水中,充分溶解后一定形成饱和溶液的是_____,其溶液的溶质质量分数为_____(精确到0.1%)。
(4)图2是有关硝酸钾溶液的实验操作及变化情况。若保持溶液的质量不变,操作Ⅰ为_____,操作Ⅱ“蒸发”还需的仪器有铁架台、酒精灯、_____。
(5)根据图1、图2,有关说法正确的是_____。
A①与②的溶质质量可能相等
B②与③的溶质质量分数一定相等
C等温度、等质量的硝酸钾和氯化钾饱和溶液,降低相同的温度,析出的晶体质量:硝酸钾>氯化钾
D等温度、等质量的硝酸钾和氯化钾饱和溶液,恒温蒸发等质量的水,析出的晶体质量:硝酸钾>氯化钾
【答案】t1℃时硝酸钾与氯化钾的溶解度相同 0≤t<t1 氯化钾 28.6% 降温 蒸发皿、玻璃棒、坩埚钳 D
【解析】
(1)由溶解度曲线可知,P点的含义是:t1℃时,硝酸钾和氯化钾的溶解度相同;
(2)由溶解度曲线可知,当温度小于t1℃时,氯化钾的溶解度大于硝酸钾的溶解度;
(3)t2℃时,硝酸钾和氯化钾的溶解度分别是63.9g、40.0g,分别将30g硝酸钾和氯化钾加入到50g水中,由溶解度的含义可知,充分溶解后一定形成饱和溶液的是氯化钾,其溶液的溶质质量分数为:![]() ×100%≈28.6%;
×100%≈28.6%;
(4)由于硝酸钾的溶解度随温度的升高而增大,图2是有关硝酸钾溶液的实验操作及变化情况,若保持溶液的质量不变,操作Ⅰ为降低温度; “蒸发”过程中用到的仪器有铁架台、酒精灯、蒸发皿、玻璃棒、坩埚钳;
(5)A、由于溶液的质量不变,①与②的溶质质量可能相等,故A正确;
B、②与③都是该温度下饱和溶液,溶质质量分数一定相等,故B正确;
C、由于温度不同,溶解度不同,等温度、等质量的硝酸钾和氯化钾饱和溶液,恒温蒸发等质量的水,析出的晶体质量无法判断,故C错误;
D、由于硝酸钾的溶解度随温度变化的幅度大于氯化钾,所以等温度、等质量的硝酸钾和氯化钾饱和溶液,降低相同的温度,析出的晶体质量:硝酸钾>氯化钾,故D正确。

【题目】某兴趣小组通过镁与稀盐酸反应探究影响反应速率的因素(镁的质量相等,镁条的形状一样,稀盐酸均过量),设计实验如表:
实验编号 | 盐酸的质量分数 | 镁的形态 | 溶液初始温度/℃ |
① | 3% | 粉末 | 30 |
② | 3% | 条状 | 20 |
③ | 6% | 粉末 | 20 |
④ | 6% | 条状 | 20 |
(1)镁与稀盐酸反应的化学方程式为______。
(2)若四组实验均以收集到250mL氢气为标准,要比较各组反应速率,则以上实验还需要测出的数据是______。
(3)实验______和______(填实验编号)是研究盐酸的浓度对该反应速率的影响。
(4)测定在不同时间产生的氢气的体积数据,绘制出图1,则实验②对应的曲线可能是______(填序号)。

(5)利用图2压力传感器进行实验,得到图3锥形瓶内的压强随时间变化的曲线图,发现实验测得的实际值比理论值偏大。请分析可能的原因______。