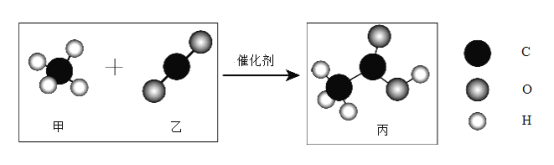
题目内容
【题目】某化学小组在Al(NO3)3和AgNO3的混合溶液中加入一定量的锌粉和铁粉,充分反应后过滤,得到固体和浅绿色溶液。
(1)写出一个有关反应的化学方程式。______
(2)向固体上滴加盐酸________(填“一定有”、“可能有”或“一定没有”)气泡产生。
(3)反应后的溶液中一定含有什么金属离子?______
【答案】![]() 或
或![]() 可能有
可能有 ![]() 、
、![]() 、
、![]() (或铝离子、锌离子、亚铁离子)
(或铝离子、锌离子、亚铁离子)
【解析】
由题意,在Al(NO3)3和AgNO3的混合溶液中加入一定量的锌粉和铁粉,根据金属活动性顺序可知,铝、锌、铁、银四种的金属活动性强弱为铝锌铁银,则锌粉和铁粉与Al(NO3)3溶液不反应,锌粉和铁粉与AgNO3溶液反应,且锌粉先与AgNO3溶液发生置换反应,充分反应后过滤,得到固体和浅绿色溶液,溶液中含有亚铁离子,说明锌粉与AgNO3溶液发生置换反应中AgNO3过量,锌粉反应完,铁粉与AgNO3溶液发生置换反应,铁粉是否完全反应未知。
(1)上述过程中有锌粉与AgNO3溶液的置换反应、铁粉与AgNO3溶液的置换反应,反应的化学方程式为![]() 、
、![]() ;
;
(2)若铁粉过量,过滤后的固体为铁粉与银的混合物,向固体上滴加盐酸有气泡产生;若AgNO3过量,过滤后的固体为银的单质,向固体上滴加盐酸没有气泡产生;所以向过滤后的固体上滴加盐酸可能有气泡产生。
(3)反应后的溶液中一定含有![]() 、
、![]() 、
、![]() ,若AgNO3溶液过量,可能含有
,若AgNO3溶液过量,可能含有![]() 。
。

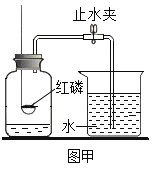
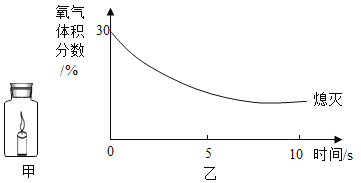
【题目】小王用图A所示装置对二氧化碳的灭火实验进行探究,观察到的现象是_____。实验的结论是_____
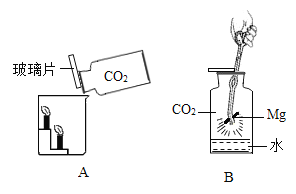
(提出问题)二氧化碳能否支持燃烧?
(猜想假设)镁能在二氧化碳中燃烧。
(查阅资料)①氧化镁、氢氧化镁均是白色难溶于水的固体。
②MgO+2HCl=MgCl2+H2O
③MgCl2+2NaOH=Mg(OH)2↓+2NaCl
(实验探究)①图中镁带剧烈燃烧,冒白烟,有黑色固体生成,并放出大量的热。
②为检验生成物的成分,做如下实验。
实验步骤 | 实验现象 | 实验结论和化学方程式 |
向放有生成物的广口瓶中加入过量稀盐酸,充分反应后过滤,在滤纸上留有黑色固体 | ||
Ⅰ:将黑色固体收集、洗涤、干燥后,点燃,在火焰上方罩一个蘸有澄清石灰水的烧杯 | a:黑色固体燃烧,烧杯内壁出现白色浑浊 | b:黑色固体是_____;反应的化学方程式是: _____、_____ |
Ⅱ:取少量滤液于试管中,逐滴加入氢氧化钠溶液 | c:开始_____,后有白色沉淀产生 | d:白烟的成分是_____ |
(反思提高)实验室中某些活泼金属引起的着火,不能用二氧化碳灭火,应用细沙灭火。