题目内容
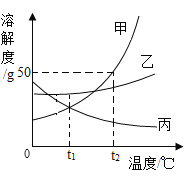
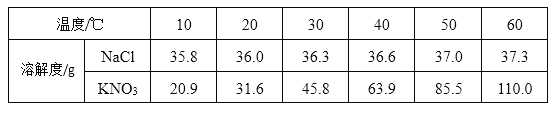
【题目】图1是甲、乙、丙三种物质的溶解度曲线,下表是NaCl和KNO3在不同温度时的溶解度。

(1)根据图1回答下列问题。
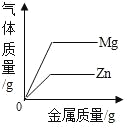
①等质量的甲、乙饱和溶液从t2 ℃降至t1 ℃,析出晶体较多的是__(填“甲”或“乙”)。
②氧气的溶解度随温度变化的规律与物质__(填“甲”“乙”或“丙”)相似。
(2)根据上表回答下列问题。
①将20 ℃的KNO3饱和溶液升温至60 ℃,溶液的溶质质量分数__(填“变大”“变小”或“不变”)。
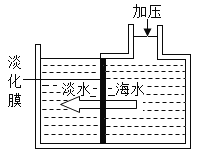
②Ⅰ.60 ℃时,按图2操作,A中溶液是__(填“饱和”或“不饱和”)溶液,C中溶液的总质量是__g。
Ⅱ.50 ℃时,将两种物质的饱和溶液(各100 g)分别加热蒸发10 g水后,再恢复到50 ℃,则下列说法正确的是__(填字母序号)。
A 有NaCl晶体析出,无KNO3晶体析出 B 两溶液中溶质与溶剂的质量比都增大
C 剩余溶液的质量:NaCl>KNO3 D 析出NaCl晶体3.7 g
【答案】甲 丙 不变 不饱和 167.6 CD
【解析】
(1)①甲物质的溶解度受温度变化影响较大,所以等质量的甲、乙饱和溶液从t2℃降至t1℃,析出晶体较多的是甲;
②氧气的溶解度随温度升高而减小,所以变化规律与图中丙相似;
(2)①将20℃的KNO3饱和溶液升温至60℃,溶解度增大,不会析出晶体,溶剂质量也不变,所以溶液的溶质质量分数不变;
②60℃时,硝酸钾的溶解度是110g,20℃时,氯化钠的溶解度是36g,硝酸钾的溶解度是31.6g,所以
I.A中溶液是不饱和溶液,C中溶液的总质量是100g+36g+31.6g=167.6g;
Ⅱ.50℃时,将两种物质的饱和溶液各100g,分别加热蒸发10g水后,再恢复到50℃,
A、有NaCl晶体析出,也会有KNO3晶体析出,故选项错误;
B、两溶液中溶质与溶剂的质量比都不变,故选项错误;
C、蒸发10g水后,硝酸钾析出的晶体多,所以剩余溶液的质量:NaCl溶液大于KNO3溶液,故选项正确;
D、析出NaCl晶体3.7g,故选项正确。故选CD。

【题目】人类社会的发展离不开能源和资源。(1)当今社会,人们生活和生产所需的能量主要来自化石燃料的燃烧。化石燃料燃烧会产生大量的二氧化碳。大量的二氧化碳排放到空气中,导致的环境问题是 ,
改善这一环境问题,你自身能做到的一件事是 。
(2)我国是一个水资源缺乏的国家,许多地方人畜饮水困难。节约用水,保护水资源是我们每位公民应尽的义务和责任。对于残留在水中的悬浮物(如树叶、废塑料等)可采用 的方法除去。不使用含磷洗衣粉是为了防止水体 。面对水资源短缺的现状,生活中的下列做法不能达到节约用水目的的是 (填字母)。
A.洗脸刷牙,随手关水 | B.洗菜用水,再来浇花 |
C.一件衣服,洗衣机洗 | D.水管漏水,及时修理 |
(3)“垃圾是放错地方的资源”。垃圾中含有人类生存和从事生产活动所需的“半成品”。垃圾可以进行分类回收,用于做肥料、燃烧发电、制沼气等。
①合成材料的应用与发展,方便了人类的生活。但废弃塑料却带来严重的“白色污染”,要解决“白色污染”问题,应该从哪些方面入手? (任答一点)。
②生活垃圾还可用于生产沼气,沼气燃烧可用于供热或发电,其完全燃烧的化学方程式为:
。
【题目】烧杯中盛有x溶液,逐滴加入(或通入)y物质,烧杯内液体的pH变化如下图所示。则符合该变化的一组物质是( )
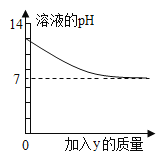
x | y | |
A | NaOH溶液 | 稀HC1(过量) |
B | 稀H2SO4 | BaC12溶液(少量) |
C | Ca(OH)2 | CO2(适量) |
D | Ca(OH)2 | Na2CO3 |
A.AB.BC.CD.D