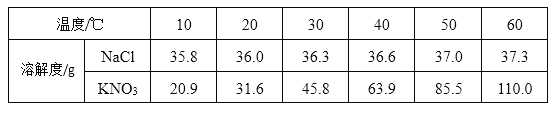
题目内容
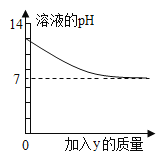
【题目】烧杯中盛有x溶液,逐滴加入(或通入)y物质,烧杯内液体的pH变化如下图所示。则符合该变化的一组物质是( )
x | y | |
A | NaOH溶液 | 稀HC1(过量) |
B | 稀H2SO4 | BaC12溶液(少量) |
C | Ca(OH)2 | CO2(适量) |
D | Ca(OH)2 | Na2CO3 |
A.AB.BC.CD.D
【答案】C
【解析】
A、氢氧化钠溶液中加入过量的盐酸,则最后溶液呈酸性,pH小于7,不符合图示变化,错误;
B、硫酸溶液呈酸性,开始时溶液的pH不可能大于7,错误;
C、氢氧化钙溶液中通入适量的二氧化碳,二氧化碳能与氢氧化钙反应生成碳酸钙沉淀和水,可以使溶液呈中性,正确;
D、氢氧化钙溶液显碱性,pH大于7,当加入碳酸钠溶液时,氢氧化钙能和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,氢氧化钠显碱性,即使溶液的pH减小,也不会减小到7.错误
故选C.

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
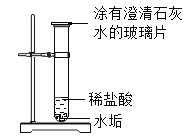
名校联盟快乐课堂系列答案【题目】某饮用水中含有较多的碳酸氢钙:Ca(HCO3)2 ,因此此水属于___水,煮沸时会有水垢生成。实验小组欲探究该水垢的主要成分:
(猜想与分析)分析Ca(HCO3)2与水的元素组成,该水垢的主要成分可能是:
Ⅰ:CaO ; Ⅱ:Ca(OH)2 ;Ⅲ:CaCO3 ; Ⅳ:Ca(OH)2和CaCO3 。
小强同学认为该水垢中不会存在CaO,因为氧化钙会与水反应_________(用化学方程式表示)。
(实验与事实)
实验 | 实验现象 | 解释或结论 |
1.将适量的水垢和水装入试管中,充分振荡后静置,取上层清液于试管中,通入CO2 | 不变浑浊 | 说明水垢中一定没有______。 |
2. | 有气泡产生,玻璃片上澄清石灰水变_______。 | 说明有CO2生成。则水垢中一定含有_________。 |
(实验启示)根据实验2,生活中除去热水瓶胆内沉积的水垢可用的物质有_________。
A 食盐水(中性) B 食醋(酸性) C 洗洁精(碱性) D 洁厕灵(酸性)
【题目】一种名为“污渍爆炸盐”的洗涤产品能高效去除衣物上的顽固污渍,某校化学研 究性学习小组的同学在老师的指导下对该产品开展了以下探究活动。
(查阅资料)“污渍爆炸盐”的主要成分是过碳酸钠(相对分子质量为 122),它是一种白 色固体粉末,易溶于水且能与水反应生成一种碳酸盐和一种强氧化性的物 质,是当前使用最为广泛的洗涤助剂之一。
(实验探究一)过碳酸钠的化学组成
为探究过碳酸钠的化学组成,同学们设计了以下实验,请按要求完成表格内容:
序号 | 实验步骤 | 实验现象 | 实验分步结论(或解释) |
① | 向盛有过碳酸钠固体的试管中加入适量水 向所得溶液中加入适量 的二氧化锰粉末 | 固体溶解,有大量气泡 产生 | 过碳酸钠可溶于水,并且能与水反应。 |
② | 将带火星的木条置于试 管口 | 木条复燃 | 在试管中产生的气体是_______;过碳酸钠溶于水能生成___________(填化学式)。 |
③ | 取序号③试管中的上层清液加入氯化钙溶液 | 产生白色沉淀 | 反应的化学方程式:___________。 |
小结 | 过碳酸钠的化学式是_________;过碳酸钠与水反应的化学方程式是______。 | ||
(实验探究二)过碳酸钠含量测定
老师给同学们一份含碳酸钠杂质的过碳酸钠样品(不含其它杂质),要求设计方案测定 该样品中过碳酸钠的含量,同学们经讨论设计了如下图所示的实验装置。图中装置 B 盛装 氢氧化钠溶液、C 盛装澄清石灰水、D 盛装浓硫酸,E、F 均装入干燥的碱石灰(主要成分: 氧化钙和氢氧化钠的固体混合物;可吸收二氧化碳和水蒸气)

(1)首先关闭活塞 K、K2,打开活塞 K1、K3、K4,通入一段时间的氮气排出锥形瓶中的空气,此时装置 B 的作用是____________;
(2)依次关闭活塞 K1、K3、K4,打开活塞 K2、K,此时锥形瓶中反应生成的气体是__________, 反应完全后关闭活塞 K,再次打开活塞 K1 通入氮气的作用是__________;
(3)同学们根据 E 装置在测定前后的质量差计算出了样品中过碳酸钠的含量。装置 F 的作用是__________。