题目内容
【题目】溶液与人类生产、生活密切相关。请回答下列问题:
(1)打开汽水瓶盖汽水自动喷出,这说明气体在水中的溶解度与_____有关。
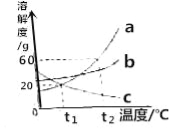
(2)甲、乙、丙三种固体物质(不含结晶水,且不与水反应)的溶解度曲线如下图所示。
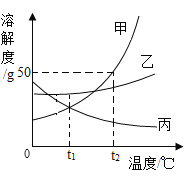
①t2℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是_____。
②t2℃时,把50g甲放入50g水中能得到甲的饱和溶液,其中溶质与溶液的质量比为_____。
③将丙的饱和溶液变为不饱和溶液,若保持溶液质量不变,可以采用_____方法。
④t2℃时,甲、乙、丙三种物质的饱和溶液降温至t1℃时,这三种溶液的溶质质量分数由大小关系是_____。
(3)向一定质量溶质质量分数为20%的硝酸钾溶液中同时加入4g硝酸钾和16g水所得的溶液中溶质质量分数为_____。
【答案】压强 甲>乙>丙 1:3 降温 乙>甲>丙 20%
【解析】
(2)①溶解度曲线上一点的纵坐标表示该点对应温度下此物质的溶解度大小,据此分析;
②溶液质量=溶质质量+溶剂质量,据此分析。
(1)打开汽水瓶盖汽水自动喷出,这说明气体在水中的溶解度与压强有关,打开瓶盖后,压强减小,则二氧化碳的溶解度减小,因此汽水自动喷出;
(2)①由溶解度曲线可知,t2℃时,甲、乙、丙三种物质对应的溶解度曲线上的点的纵坐标大小关系为:甲>乙>丙,因此t2℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是:甲>乙>丙;
②由溶解度曲线可知,t2℃时,甲的溶解度大小为50g,因此把50g甲放入50g水中能得到甲的饱和溶液,该溶液的组成为:溶剂质量为50g,溶质质量为25g,则溶液质量=50g+25g=75g,因此溶质与溶液的质量比=25g:75g=1:3;
③丙的溶解度大小随温度的降低而增大,因此将丙的饱和溶液变为不饱和溶液,若保持溶液质量不变,可以采用降温的方法;
④甲、乙的溶解度随温度降低而减小,丙的溶解度随温度降低而增大,所以分别将t2℃时三种物质的饱和溶液降温至t1℃,甲、乙析出晶体,溶质的质量分数减小,丙溶解度变大,溶质的质量分数与降温前相等,饱和溶液中,溶质的溶解度越大则溶质质量分数也就越大,而t1℃时乙的溶解度大于甲的溶解度大于t2℃时丙的溶解度,故所得溶液中溶质的质量分数的大小关系为乙>甲>丙;
(3)向一定质量溶质质量分数为20%的硝酸钾溶液中同时加入4g硝酸钾和16g水所得的溶液中溶质质量分数,可看作是原20%的硝酸钾溶液中,加入溶质是4g、溶剂是16g的溶液,加入的溶液的溶质质量分数=4g÷(4g+16g)×100%=20%。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案