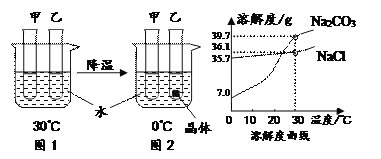
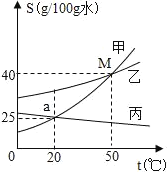
题目内容
【题目】现有一包由5.6g铁、7.2g镁、1.4g碳混合而成的粉末,把它加入一定量的Cu(NO3)2溶液中。实验结束后,测得剩余固体中含有三种物质。则剩余固体的质量可能会( )
A. 25.8gB. 26.8gC. 27.8gD. 28.8g
【答案】B
【解析】
铁、镁、碳三种物质加入一定量的Cu(NO3)2溶液中,Cu(NO3)2先与镁反应生成硝酸镁和铜,若还存在Cu(NO3)2,Cu(NO3)2再与铁反应生成硝酸亚铁和铜,碳粉Cu(NO3)2不与反应,在实验结束后,测得剩余固体中含有三种物质,镁已完全反应,则三种物质是不能反应的碳、反应生成的铜和没有或部分反应的铁;
当铁完全反应,对应质量关系:

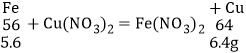
剩余固体质量=1.4g+6.4g+19.2g=27g;
当铁没有反应,剩余固体质量:1.4g+5.6g+19.2g=26.2g,
由以上分析可知,剩余固体的质量大于26.2g,小于27g,即剩余固体的质量可能是26..8g。故选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】某公司生产的新型融雪剂的成分是无水CaCl2和少量的氯化钠,为测定融雪剂中氯化钙的含量,化学兴趣小组的同学称取该样品12g,加水充分溶解,得到溶液50g,然后取一定质量分数的碳酸钠溶液100g平均分五次加入,充分振荡,实验数据见表。请你分析数据并进行有关计算。
次 数 | 1 | 2 | 3 | 4 | 5 |
加入碳酸钠溶液的质量/g | 20 | 20 | 20 | 20 | 20 |
生成沉淀的质量/g | 2.5 | x | 7.5 | 10 | 10 |
(1)上表中x的数值为_____。第_____次加入的碳酸钠与氯化钙恰好完全反应。
(2)样品中氯化钙的质量分数是多少_____?
(3)恰好完全反应时过滤,所得不饱和溶液的溶质质量分数是多少_____?