题目内容
【题目】为了测定混有少量杂质的高锰酸钾固体样品中高锰酸钾的质量分数,取20g样品加热(杂质不反应),剩余固体的质量与加热时间的关系如表所示:
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
剩余固体质量/g | 20 | 20 | 19.6 | 18.8 | 18.6 | 18.4 | 18.4 |
(1)t0至t1时间段,固体质量不变的原因是_________。
(2)反应中产生氧气的质量是?
(3)求样品中高锰酸钾的质量是多少?(写出计算过程)
【答案】(1)此时温度未达到高锰酸钾的分解温度
(2)1.6g
(3)15.8g
【解析】
(1)高锰酸钾需要一定温度才能发生反应,从t0至t1时间段内还没有达到高锰酸钾的分解温度,所以不发生反应,因此不会使固体质量发生变化;
故答案为:此时温度未达到高锰酸钾的分解温度。
(2)高锰酸钾分解生成锰酸钾、二氧化锰和氧气,而杂质不参与反应,所以减少的质量就为生成氧气的质量,当固体质量不再减少,说明反应完全发生,所以氧气质量=20g-18.4g=1.6g;
故答案为:1.6g。
(3)设高锰酸钾质量为m,
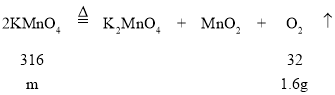
![]() m=15.8g;
m=15.8g;
答:样品中高锰酸钾的质量为15.8g。
故答案为:15.8g。

练习册系列答案
相关题目