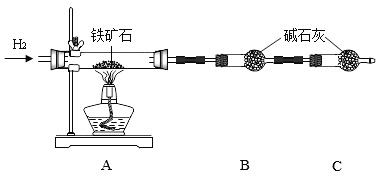
题目内容
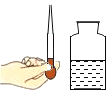
【题目】t1℃时,将 a、b 两种固体物质(均不含结晶水)各 25g,分别加入盛有 l00g 水的烧杯中,充分搅拌后 现象如图甲所示;升温到 t2℃时,忽略水分蒸发,现象如图乙所示。图丙是 a、b 两种固体物质在水中的溶解度曲线。下列说法正确的是
A.图甲中两烧杯内 a、b 溶液的溶质质量分数相等
B.图乙中烧杯内 b 溶液的溶质质量分数为 25%
C.图丙中曲线 M 表示 b 物质的溶解度曲线
D.若 a 中混有少量 b,可采用蒸发结晶的方法提纯 a
【答案】A
【解析】
A、t1℃时,a、b物质的溶解度相等,将a、b两种固体物质各25g,分别加入盛有100g水的烧杯中,充分搅拌后,都有固体剩余,都是该温度的变化溶液,所以图甲中两烧杯内a、b溶液的溶质质量分数相等,故正确;
B、图乙中烧杯内b溶液的固体没有全部溶解度,溶质质量分数小于![]() ×100%=20%,故错误;
×100%=20%,故错误;
C、升温到t2℃时,a物质全部溶解,b物质还有剩余,所以图丙中曲线M表示a物质的溶解度曲线,故错误;
D、a物质的溶解度随温度的降低而,所以减小若a中混有少量b,可将其溶液降温结晶、过滤以提纯a,故错误。
故选A。

【题目】为了测定混有少量杂质的高锰酸钾固体样品中高锰酸钾的质量分数,取20g样品加热(杂质不反应),剩余固体的质量与加热时间的关系如表所示:
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
剩余固体质量/g | 20 | 20 | 19.6 | 18.8 | 18.6 | 18.4 | 18.4 |
(1)t0至t1时间段,固体质量不变的原因是_________。
(2)反应中产生氧气的质量是?
(3)求样品中高锰酸钾的质量是多少?(写出计算过程)
【题目】某研究性学习小组在做“镁与稀盐酸反应”的实验时,发现一个意外现象,试管底部有灰白色沉淀生成。
[提出问题]出现灰白色沉淀是否为偶然现象?
[设计实验]实验1:向4份相同体积与浓度的稀盐酸中分别加入一定长度的镁带。
试管 | A | B | C | D |
镁带长度 | 1 cm | 2cm | 3 cm | 4cm |
实验现象 | 快速反应产生大量气泡,试管发热。最终镁带溶解 | 快速反应产生大量气泡,试管发热,镁带溶解,出现少量白色浑浊 | 快速反应产生大量气泡,试管发热,镁带溶解,出现灰白色沉淀 | 快速反应产生大量气泡,试管发热,镁带溶解,溶液变浑浊,久置得大量灰白色沉淀 |
沉淀量 | 无沉淀生成 | 少量沉淀 | 沉淀较多 | 沉淀很多 |
据表分析,______是实验出现“异常”的主要因素写出产生气泡反应的化学方程式____,实验前用砂纸打磨镁条的原因是______。
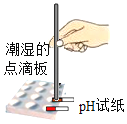
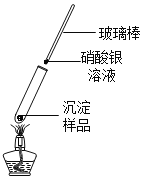
实验2:将少量灰白色沉淀用蒸溜水清洗并室温晾干。然后取样,按图加热固体,用湿润的蓝色石蕊试纸检验气体产物试纸变红;若另取一端用硝酸银溶液浸润的玻璃棒悬于试管口,出现白色浑浊,则灰白色沉淀中一定含有______元素。
用pH计监测反应过程中溶液pH变化并读数。实验结果如下:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 | … | 放置过夜 |
溶液pH | 2.0 | 5.8 | 7.4 | 8.0 | 8.6 | 9.0 | 9.3 | 9.6 | 9.8 | 10.0 | 10.0 | … | 10.2 |
实验现象 | 一 | 大量气泡,无沉淀生成 | 镁带慢慢溶解,气泡量减少 ,溶液变浑浊,烧杯内灰白色沉淀逐渐增加 | ||||||||||
气泡减慢的原因是______,充分反应后溶液的pH____(填“>”、“<”或“=”)7。
[实验拓展]镁与稀盐酸反应时.试管中还出现白雾。哪种因素会促进反应过程中出现白雾?请设计实验进行验证。
影响因素:____________。
实验验证:____________。