题目内容
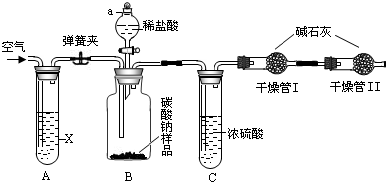
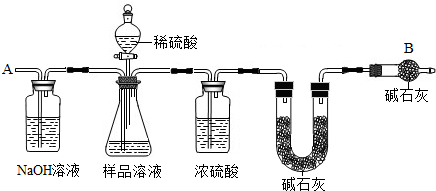
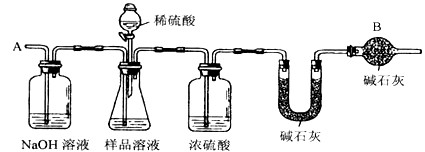
某纯碱样品如果含有杂质,只可能含有NaHCO3、K2CO3中的一种或两种杂质.某化学兴趣小组为探究该样品的成分,称量样品m1 g,与足量的稀盐酸充分反映,得到CO2的质量为m2 g.下列推断中正确的是
- A.若
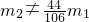 ,则原样品一定含有杂质
,则原样品一定含有杂质 - B.若
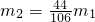 ,则原样品一定不含有杂质
,则原样品一定不含有杂质 - C.若
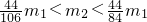 ,则原样品一定含有NaHCO3,可能含有K2CO3
,则原样品一定含有NaHCO3,可能含有K2CO3 - D.若
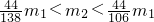 ,则原样品一定含有K2CO3,不可能含有NaHCO3
,则原样品一定含有K2CO3,不可能含有NaHCO3
AC
分析:解答该题可以根据所发生的化学反应结合根据化学方程式的计算,分别求出碳酸钠、碳酸氢钠及碳酸钾与足量的盐酸反应生成气体的质量,然后利用平均值法来分析并得出正确的答案.
解答:根据Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
m1g m2g
可知: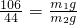
即:m2=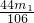
根据NaHCO3+HCl═NaCl+H2O+CO2↑
84 44
m1g m2g
可知: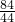 =
=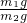
即:m=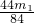
根据K2CO3+2HCl═2KCl+H2O+CO2↑
138 44
m1g m2g
可知: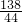 =
=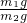
即:m2=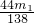
A、根据上面的计算可以知道若纯碱样品中只有碳酸钠,则生成二氧化碳气体的质量满足:m2=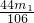 ,若m2≠
,若m2≠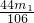 ,则说明样品中含有杂质,故A正确;
,则说明样品中含有杂质,故A正确;
B、由于等质量的碳酸钠、碳酸氢钠和碳酸钾与足量的盐酸反应生成气体由多到少的顺序为:碳酸氢钠>碳酸钠>碳酸钾,所以可以可以判断若碳酸钠中同时混有了碳酸钾和碳酸氢钠,则m1g混合物可能产生的二氧化碳的质量也可能与纯净的碳酸钠生成二氧化碳气体的质量相等,即m2=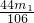 也可能成立,故B不正确;
也可能成立,故B不正确;
C、结合B的分析,若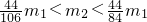 ,则此时混有的杂质一定含有碳酸氢钠,否则产生二氧化碳气体的质量不可能大于
,则此时混有的杂质一定含有碳酸氢钠,否则产生二氧化碳气体的质量不可能大于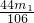 ,混有极少量的碳酸钾也不会影响产生二氧化碳气体的质量,所以混合物可能含有碳酸钾,故C正确;
,混有极少量的碳酸钾也不会影响产生二氧化碳气体的质量,所以混合物可能含有碳酸钾,故C正确;
D、结合B和C的分析及解答,可以知道:若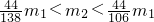 ,则原样品一定含有K2CO3,当然也可能含有碳酸氢钠,故D不正确.
,则原样品一定含有K2CO3,当然也可能含有碳酸氢钠,故D不正确.
故选AC.
点评:本题主要考查有关化学方程式的计算和含杂质物质的推断,难度较大,要学会用平均值法解答题目并判断混合物的组成.
分析:解答该题可以根据所发生的化学反应结合根据化学方程式的计算,分别求出碳酸钠、碳酸氢钠及碳酸钾与足量的盐酸反应生成气体的质量,然后利用平均值法来分析并得出正确的答案.
解答:根据Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
m1g m2g
可知:
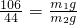
即:m2=
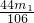
根据NaHCO3+HCl═NaCl+H2O+CO2↑
84 44
m1g m2g
可知:
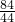 =
=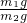
即:m=
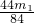
根据K2CO3+2HCl═2KCl+H2O+CO2↑
138 44
m1g m2g
可知:
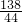 =
=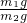
即:m2=
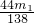
A、根据上面的计算可以知道若纯碱样品中只有碳酸钠,则生成二氧化碳气体的质量满足:m2=
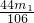 ,若m2≠
,若m2≠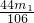 ,则说明样品中含有杂质,故A正确;
,则说明样品中含有杂质,故A正确;B、由于等质量的碳酸钠、碳酸氢钠和碳酸钾与足量的盐酸反应生成气体由多到少的顺序为:碳酸氢钠>碳酸钠>碳酸钾,所以可以可以判断若碳酸钠中同时混有了碳酸钾和碳酸氢钠,则m1g混合物可能产生的二氧化碳的质量也可能与纯净的碳酸钠生成二氧化碳气体的质量相等,即m2=
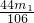 也可能成立,故B不正确;
也可能成立,故B不正确;C、结合B的分析,若
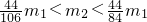 ,则此时混有的杂质一定含有碳酸氢钠,否则产生二氧化碳气体的质量不可能大于
,则此时混有的杂质一定含有碳酸氢钠,否则产生二氧化碳气体的质量不可能大于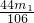 ,混有极少量的碳酸钾也不会影响产生二氧化碳气体的质量,所以混合物可能含有碳酸钾,故C正确;
,混有极少量的碳酸钾也不会影响产生二氧化碳气体的质量,所以混合物可能含有碳酸钾,故C正确;D、结合B和C的分析及解答,可以知道:若
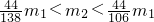 ,则原样品一定含有K2CO3,当然也可能含有碳酸氢钠,故D不正确.
,则原样品一定含有K2CO3,当然也可能含有碳酸氢钠,故D不正确.故选AC.
点评:本题主要考查有关化学方程式的计算和含杂质物质的推断,难度较大,要学会用平均值法解答题目并判断混合物的组成.

练习册系列答案
相关题目