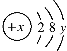题目内容
【题目】某校兴趣小组想亲身感受科学家的探究历程,他们选择了《空气中氧气含量的粗略测定》为探究内容。首先,他们分组进行讨论:
(1)小光组认为,选择的药品既要能消耗氧气,又不会与空气中的其他成分反应,而且生成物为固体。他们应该选择________________。
A蜡烛 B硫粉 C铜丝
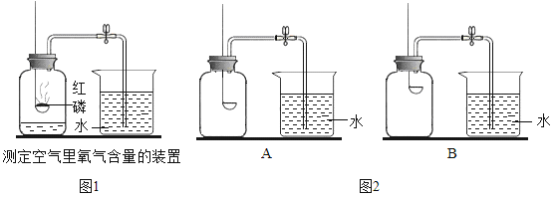
(2)小明组设计了如图2所示的两套实验装置,你认为合理的是(填序号)___________。为了确保实验的成功,实验前应______________。
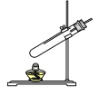
(3)小芳组设计了如图1实验方案:在燃烧匙内盛过量红磷,点燃后立即插入集气瓶内,塞紧橡皮塞,观察到集气瓶内产生大量的白烟,写出红磷燃烧的文字或符号表达式_______________,该反应的基本反应类型为_____________,待冷却至室温,打开止水夹,观察到_______________。由此实验可以推论出剩余气体的性质 (填一条物理性质和一条化学性质)___________。
(4)小明组做该实验时,测出氧气的含量低于实际值,请你分析其中的原因:_____________。
【答案】C A 检查装置气密性 ![]() 化合反应 烧杯内的水进入集气瓶 难溶于水、不能燃烧也不支持燃烧 装置气密性不好、红磷量不足、没有恢复到室温就打开弹簧夹等
化合反应 烧杯内的水进入集气瓶 难溶于水、不能燃烧也不支持燃烧 装置气密性不好、红磷量不足、没有恢复到室温就打开弹簧夹等
【解析】
(1)A.蜡烛燃烧消耗氧气,同时生成二氧化碳气体,不符合题意;
B.硫粉燃烧消耗氧气,同时生成二氧化硫气体,不符合题意;
C.铜丝在加热条件下消耗氧气,生成氧化铜固体,符合题意;
故填:C。
(2)氧气的密度比空气大,B装置中燃烧匙的位置偏上,红磷燃烧时,不能把集气瓶下部的氧气耗尽,因此不能选B,应选A;由于本实验涉及气体的消耗和气压的变化,因此首先应保证装置的气密性良好,实验前应检查装置气密性。
(3)红磷在空气(氧气)中燃烧,生成五氧化二磷,反应的文字或符号表达式为:![]() ,该反应由两种物质反应生成一种物质,属于化合反应,集气瓶内氧气被消耗,待冷却至室温,打开止水夹,观察到烧杯内的水进入集气瓶,由此实验可以推论出剩余气体无色透明、不能燃烧也不支持燃烧。
,该反应由两种物质反应生成一种物质,属于化合反应,集气瓶内氧气被消耗,待冷却至室温,打开止水夹,观察到烧杯内的水进入集气瓶,由此实验可以推论出剩余气体无色透明、不能燃烧也不支持燃烧。
(4)小明组做该实验时,测出氧气的含量低于实际值,可能的原因是装置气密性不好、红磷量不足、没有恢复到室温就打开弹簧夹等。

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】研究和控制化学反应条件有重要意义。
(1)同学们想探究过氧化氢的浓度对反应速率的影响。在其他条件相同的情况下进行了三次实验,记录各收集一瓶相同体积氧气所需要的时间。
实验 | 30%双氧水 的质量(g) | 加入的水 的体积(mL) | 二氧化锰质量(g) | 收集时间(s) |
1 | 10 | 20 | 5 | 200 |
2 | 20 | 20 | 5 | 100 |
3 | 30 | 20 | ______________ | 67 |
①取用二氧化锰的仪器是 ______。
②二氧化锰在过氧化氢的分解中起_________作用。
③实验3中,加入的二氧化锰质量为_________g。
④相同条件下,实验3产生氧气的速率最快,说明_________。
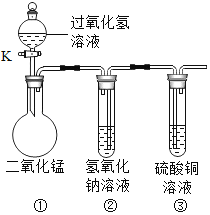
(2)同学通过查阅资料得知,过氧化氢在70℃以上会较快分解产生氧气。为了验证加热过氧化氢也可以产生氧气,同学们选择右图装置(气密性良好)进行实验。实验中观察试管内产生气泡,但将带火星的木条放在导管口没有复燃,可能的原因是___________,同学分析原因后,采用了______法收集气体,再检验,证明加热双氧水也可产生氧气。