题目内容
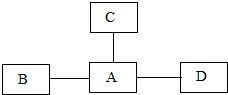 A、B、C、D都是我们初三化学本学期学习过的物质,其相互反应关系如图所示:
A、B、C、D都是我们初三化学本学期学习过的物质,其相互反应关系如图所示:(1)若A、B、C、D都是单质,且B、C、D都能分别和A发生反应,其中B是目前世界年产量最高的金属,C是最理想的燃料,D为黑色固体,则C为
H2
H2
(填化学式),请写出B与A反应的化学方程式3Fe+2O2
Fe3O4
| ||
3Fe+2O2
Fe3O4
.
| ||
(2)若B、C、D是三种化合物,且都能通过分解反应生成一种可以支持燃烧的气体A,已知B为固体,C、D为液体.且B、C、D的相对分子质量依次减小,试求出C物质中各元素的质量比
1:16
1:16
.分析:根据题干提供的信息进行推断,(1)C是最理想的燃料,则C为氢气,B是目前世界年产量最高的金属,则B为铁,B,C,D都能分别和A发生反应,则A可能是氧气,D为黑色固体,则D为碳;
(2)A能支持燃烧,则A为氧气,能分解生成氧气的物质有高锰酸钾、双氧水和水,B,C,D的相对分子质量依次减小,则B为高锰酸钾,C为双氧水,D是水;
(2)A能支持燃烧,则A为氧气,能分解生成氧气的物质有高锰酸钾、双氧水和水,B,C,D的相对分子质量依次减小,则B为高锰酸钾,C为双氧水,D是水;
解答:解:(1)C是最理想的燃料,则C为氢气,B是目前世界年产量最高的金属,则B为铁,B,C,D都能分别和A发生反应,则A可能是氧气,D为黑色固体,则D为碳;所以C的化学式为H2;B与A的反应是铁与氧气生成四氧化三铁的过程,其方程式为3Fe+2O2
Fe3O4 ;
(2))A能支持燃烧,则A为氧气,能分解生成氧气的物质有高锰酸钾、双氧水和水,B,C,D的相对分子质量依次减小,则B为高锰酸钾,C为双氧水,D是水;由于C的化学式为H2O2,所以氢氧元素的质量比是1×2:16×2=1:16;
故答案为:(1)H2;3Fe+2O2
Fe3O4;(2)1:16;
| ||
(2))A能支持燃烧,则A为氧气,能分解生成氧气的物质有高锰酸钾、双氧水和水,B,C,D的相对分子质量依次减小,则B为高锰酸钾,C为双氧水,D是水;由于C的化学式为H2O2,所以氢氧元素的质量比是1×2:16×2=1:16;
故答案为:(1)H2;3Fe+2O2
| ||
点评:此题为物质推断题,完成此题,可以依据已有物质的性质结合题干提供的信息进行.

练习册系列答案
相关题目

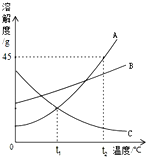 如图是A、B、C三种物质的溶解度曲线,我能根据此图回答下列问题:
如图是A、B、C三种物质的溶解度曲线,我能根据此图回答下列问题: