题目内容
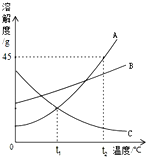 如图是A、B、C三种物质的溶解度曲线,我能根据此图回答下列问题:
如图是A、B、C三种物质的溶解度曲线,我能根据此图回答下列问题:(1)
t1℃
t1℃
℃时,物质A和C的溶解度相等;(2)等质量的A、B、C三种物质的饱和溶液同时从t2℃降温到t1℃,其中溶质质量分数没有发生改变的是
C
C
;(3)t2℃时,A物质的溶解度是
45
45
g.小丽向100gt2℃的水中加入50gA物质,意外发现全部溶解,一段时间后又有部分A物质的晶体析出.我认为全部溶解原因是A物质溶于水时放热
A物质溶于水时放热
(4)从改变温度的角度如何让C的不饱和溶液变为饱和溶液,
升高温度
升高温度
(5)若分别将100gA、B的饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的是
A
A
A.A、B都是饱和溶液 B.溶质质量分数:A>B
C.溶液质量:A>B D.所含溶剂质量:A<B.
分析:(1)溶解度曲线的交点表示该温度下两物质的溶解度相等;
(2)C的溶解度随温度的降低而增大,故降温溶质的质量分数不变;
(3)根据固体物质的溶解度曲线可以:查出某物质在一定温度时的溶解度,A的溶解度随温度升高而增大,并据此温度下A的溶解度分析解答;
(4)C的溶解度随温度的降低而增大,故C的不饱和溶液变为饱和溶液可采取升温的方法;
(5)据AB的溶解度随温度变化的变化情况,从而可以确定温度变化时溶液中量的变化.
(2)C的溶解度随温度的降低而增大,故降温溶质的质量分数不变;
(3)根据固体物质的溶解度曲线可以:查出某物质在一定温度时的溶解度,A的溶解度随温度升高而增大,并据此温度下A的溶解度分析解答;
(4)C的溶解度随温度的降低而增大,故C的不饱和溶液变为饱和溶液可采取升温的方法;
(5)据AB的溶解度随温度变化的变化情况,从而可以确定温度变化时溶液中量的变化.
解答:解:(1)t1℃时,物质A和C的溶解度曲线交于一点,二者的溶解度相等;
(2)等质量的A、B、C三种物质的饱和溶液同时从t2℃降温到t1℃,C的溶解度随温度的降低而增大,故降温溶质的质量分数不变,AB的溶解度随温度的降低而减小,溶质质量分数减小;
(3)t2℃时,A物质的溶解度是45g.因为A的溶解度随温度的升高而增大,若开始发现全部溶解,一段时间后又有部分晶体析出说明开始物质溶于水放热,温度升高,溶解度增大,冷却后溶液温度降低,溶解度又恢复到45g,所以析出晶体;
(4)C的溶解度随温度的降低而增大,故C的不饱和溶液变为饱和溶液可采取升温的方法;
(5)A.AB的溶解度随温度的降低而减小,故降低温度A、B析出晶体,都是饱和溶液,正确;
B.降温后AB依然是饱和溶液,根据饱和时质量分数的计算式
×100%,即溶解度越大质量分数也就越大,t1℃时B的溶解度大于A的溶解度,故溶质质量分数:A<B,故错误;
C.降低温度A、B析出晶体,A的溶解度变化幅度大,析出晶体多,所以溶液质量:A<B,故错误;
D.降温后AB依然是饱和溶液,且t1℃时B的溶解度大于A的溶解度,故所含溶剂质量:A>B;
故答案为:(1)t1℃;(2)C;(3)45;A物质溶于水时放热;(4)升高温度;(5)A.
(2)等质量的A、B、C三种物质的饱和溶液同时从t2℃降温到t1℃,C的溶解度随温度的降低而增大,故降温溶质的质量分数不变,AB的溶解度随温度的降低而减小,溶质质量分数减小;
(3)t2℃时,A物质的溶解度是45g.因为A的溶解度随温度的升高而增大,若开始发现全部溶解,一段时间后又有部分晶体析出说明开始物质溶于水放热,温度升高,溶解度增大,冷却后溶液温度降低,溶解度又恢复到45g,所以析出晶体;
(4)C的溶解度随温度的降低而增大,故C的不饱和溶液变为饱和溶液可采取升温的方法;
(5)A.AB的溶解度随温度的降低而减小,故降低温度A、B析出晶体,都是饱和溶液,正确;
B.降温后AB依然是饱和溶液,根据饱和时质量分数的计算式
| 溶解度 |
| 溶解度+100g |
C.降低温度A、B析出晶体,A的溶解度变化幅度大,析出晶体多,所以溶液质量:A<B,故错误;
D.降温后AB依然是饱和溶液,且t1℃时B的溶解度大于A的溶解度,故所含溶剂质量:A>B;
故答案为:(1)t1℃;(2)C;(3)45;A物质溶于水时放热;(4)升高温度;(5)A.
点评:本题难度较大,主要考查了固体溶解度曲线所表示的意义及根据固体溶解度曲线解决相关的问题,从而培养学生对知识的应用能力.

练习册系列答案
相关题目
 17、如图是A、B、C三种固体物质的溶解度曲线示意图,试回答下列问题.
17、如图是A、B、C三种固体物质的溶解度曲线示意图,试回答下列问题. 29、如图是a、b、c三种固体物质的溶解度曲线图.
29、如图是a、b、c三种固体物质的溶解度曲线图. 16、如图是A、B、C三种固体物质的溶解度随温度变化的曲线图.根据图回答:
16、如图是A、B、C三种固体物质的溶解度随温度变化的曲线图.根据图回答: (1)如图是A、B、C三种物质的溶解度曲线.请回答:
(1)如图是A、B、C三种物质的溶解度曲线.请回答:
