题目内容
为研究二氧化锰、加热对过氧化氢分解的影响,某同学设计了如下实验:
对此实验,让我们继续思考并研究几个问题:
问题①:催化剂二氧化锰(MnO2)的用量对反应速率有没有影响?
我的实验方案是:每次均用30mL10%的过氧化氢(H2O2)溶液,采用不同量二氧化锰(MnO2)粉末作催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他条件均相同)
请你分析表中数据并回答:MnO2的用量对反应速率有无影响,如果有,怎样影响?
问题②:过氧化氢(H2O2)溶液的浓度对反应速率有没有影响?你的对比实验方案是:
问题③:还有哪些因素可能影响该反应的速率呢?请说出你的一个猜想:
| 实验步骤(夹持固定装置已略去) | A、B、C三支试管中分别盛有等体积5%的过氧化氢溶液,如图所示进行实验.仪器a的名称是 试管 试管 ,C中用于加热仪器的名称是酒精灯 酒精灯  | ||||
| 实验现象 | A:试管壁有气泡附着,带火星的木条不复燃. B:有大量气泡产生,带火星的木条复燃. C:有大量气泡产生,带火星的木条不复燃. D:有大量气泡产生,用带火星的木条检验收集的气体,木条复燃. | ||||
| 分析 | B试管中发生反应的文字表达式 过氧化氢
过氧化氢 .
实验结束后仪器b中的液体质量都减少,原因是 反应生成了氧气逸出 反应生成了氧气逸出 加热反应的过程中有水蒸气逸出 加热反应的过程中有水蒸气逸出 | ||||
| 结论 | ①分析A、B实验可以得出的结论是: 二氧化锰可以加快过氧化氢的分解 二氧化锰可以加快过氧化氢的分解 .②加热 能 能 (填“能”或“不能”)促进过氧化氢分解产生氢气. |
问题①:催化剂二氧化锰(MnO2)的用量对反应速率有没有影响?
我的实验方案是:每次均用30mL10%的过氧化氢(H2O2)溶液,采用不同量二氧化锰(MnO2)粉末作催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他条件均相同)
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 二氧化锰( MnO2 )粉末用量(g) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 |
| 所用时间(t) | 170 | 80 | 70 | 50 | 40 | 30 | 20 | 20 |
二氧化锰的量不同,所用时间不同
二氧化锰的量不同,所用时间不同
问题②:过氧化氢(H2O2)溶液的浓度对反应速率有没有影响?你的对比实验方案是:
在其它条件一定的情况下,过氧化氢浓度越高,反应速率越快
在其它条件一定的情况下,过氧化氢浓度越高,反应速率越快
问题③:还有哪些因素可能影响该反应的速率呢?请说出你的一个猜想:
探究温度是否对反应速率有影响
探究温度是否对反应速率有影响
.分析:通过加入二氧化锰与不加二氧化锰过氧化氢放出氧气速率的比较,探究二氧化锰对过氧化氢分解的影响;通过对比加热与不加热的情况下,过氧化氢分解放出氧出速率的不同,探究加热对过氧化氢分解的影响.
①由题目中提供的信息每次实验过氧化氢的量相同,二氧化锰的量不同,制取的氧气量相同,所用时间不同,可以看出是检验二氧化锰的用量对反应速度的影响.
②其它条件相同,过氧化氢的浓度不同,生成相同氧气的时间不同.此步是检验反应物浓度的改变,对反应速度的影响.
③探究温度对反应速度的影响,应保持其它条件相同,改变反应温度来观察反应速度的变化.
①由题目中提供的信息每次实验过氧化氢的量相同,二氧化锰的量不同,制取的氧气量相同,所用时间不同,可以看出是检验二氧化锰的用量对反应速度的影响.
②其它条件相同,过氧化氢的浓度不同,生成相同氧气的时间不同.此步是检验反应物浓度的改变,对反应速度的影响.
③探究温度对反应速度的影响,应保持其它条件相同,改变反应温度来观察反应速度的变化.
解答:解:[实验步骤]仪器a用作少量物质的反应容器的试管;用于加热的仪器酒精灯.故答:试管;酒精灯;
[分析]B试管内盛有过氧化氢和二氧化锰,二氧化锰加快反应放出氧气的速率;故答:过氧化氢
水+氧气;
对盛有过氧化氢溶液的试管加热,观察到有气体放出,检验放出气体为氧气,说明加热时过氧化氢分解放出氧气,所以过氧化氢质量减少;另外,加热时会用少量水受热蒸发,也导致溶液质量减小.故答:①反应生成了氧气逸出,②加热反应的过程中有水蒸气逸出;
[结论]①A试管观察到气泡附着在管壁,说明放出氧气量很少,放出速度缓慢;而B试管内有大量气泡,并且很快就达到一定浓度可以使带火星木条复,说明放出氧气速度明显快于A试管.因此说,二氧化锰可以加快过氧化氢的分解;
②D操作收集到的气体经检验为氧气,同样加热的C操作与未经加热的A操作相比,加热时放出氧气的速度明显快于不加热.因此可以说,加热也能加快过氧化氢的分解.
故答:①二氧化锰能加快过氧化氢分解;②能.
对此实验,让我们继续思考并研究几个问题:
问题①由表中可以看出其它条件相同,只有二氧化锰的量不同,则反应速度不同.
问题②每次均取5mL30%的过氧化氢溶液,然后稀释成不同浓度的溶液进行实验.记录数据:过氧化氢溶液的浓度多少;MnO2用量(g)多少;收集到540毫升气体所用时间(s)多少;绘制表格分析表中数据,则可以看出其它条件相同,只有过氧化氢的浓度不同,则反应速度不同,它的浓度越高反应速度越快.
故答案为:在其它条件一定的情况下,过氧化氢浓度越高,反应速率越快
问题③探究温度对反应速度的影响,应控制其它条件相同,改变反应的温度,来探究反应的速度.
故答案为:试管;酒精灯;过氧化氢
水+氧气;反应生成了氧气逸出;加热反应的过程中有水蒸气逸出;二氧化锰可以加快过氧化氢的分解.能;问题①:二氧化锰的量不同,所用时间不同
问题②:过氧化氢(H2O2)溶液的浓度对反应速率有没有影响?对比实验方案是:
记录数据:过氧化氢溶液的浓度多少;MnO2用量(g)多少;收集到540毫升气体所用时间(s)多少;绘制表格分析表中数据,则可以看出其它条件相同,只有过氧化氢的浓度不同,则反应速度不同,它的浓度越高反应速度越快;
问题③:探究温度是否对反应速率有影响.
[分析]B试管内盛有过氧化氢和二氧化锰,二氧化锰加快反应放出氧气的速率;故答:过氧化氢
| 二氧化锰 |
对盛有过氧化氢溶液的试管加热,观察到有气体放出,检验放出气体为氧气,说明加热时过氧化氢分解放出氧气,所以过氧化氢质量减少;另外,加热时会用少量水受热蒸发,也导致溶液质量减小.故答:①反应生成了氧气逸出,②加热反应的过程中有水蒸气逸出;
[结论]①A试管观察到气泡附着在管壁,说明放出氧气量很少,放出速度缓慢;而B试管内有大量气泡,并且很快就达到一定浓度可以使带火星木条复,说明放出氧气速度明显快于A试管.因此说,二氧化锰可以加快过氧化氢的分解;
②D操作收集到的气体经检验为氧气,同样加热的C操作与未经加热的A操作相比,加热时放出氧气的速度明显快于不加热.因此可以说,加热也能加快过氧化氢的分解.
故答:①二氧化锰能加快过氧化氢分解;②能.
对此实验,让我们继续思考并研究几个问题:
问题①由表中可以看出其它条件相同,只有二氧化锰的量不同,则反应速度不同.
问题②每次均取5mL30%的过氧化氢溶液,然后稀释成不同浓度的溶液进行实验.记录数据:过氧化氢溶液的浓度多少;MnO2用量(g)多少;收集到540毫升气体所用时间(s)多少;绘制表格分析表中数据,则可以看出其它条件相同,只有过氧化氢的浓度不同,则反应速度不同,它的浓度越高反应速度越快.
故答案为:在其它条件一定的情况下,过氧化氢浓度越高,反应速率越快
问题③探究温度对反应速度的影响,应控制其它条件相同,改变反应的温度,来探究反应的速度.
故答案为:试管;酒精灯;过氧化氢
| 二氧化锰 |
问题②:过氧化氢(H2O2)溶液的浓度对反应速率有没有影响?对比实验方案是:
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 过氧化氢溶液的浓度 | ||||||||
| MnO2用量(g) | ||||||||
| 收集到540毫升气体所用时间(s) |
问题③:探究温度是否对反应速率有影响.
点评:相同时间内放出氧气的较多时,可以观察到气泡量较多,可推断出分解的速度较快;利用对比的方式进行实验探究的知识,培养了学生分析问题解决问题的能力,认识了对化学反应速度影响的因素.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
为研究二氧化锰、加热对过氧化氢分解的影响,某同学设计了如下实验:
| 实验步骤(夹持固定装置已略去) | A、B、C三支试管中分别盛有等体积5%的过氧化氢溶液,如下图所示进行实验.仪器a的名称是__________,C中用于加热仪器的名称是_________.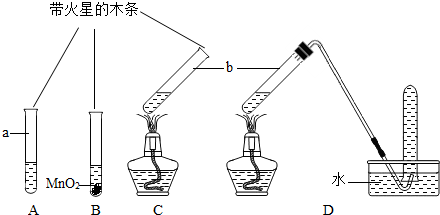 |
| 实验现象 | A:试管壁有气泡附着,带火星的木条不复燃. B:有大量气泡产生,带火星的木条复燃. C:有大量气泡产生,带火星的木条不复燃. D:有大量气泡产生,用带火星的木条检验收集的气体,木条复燃. |
| 分析 | B试管中发生反应的化学方程式是______________. 实验结束后仪器b中的液体质量都减少,原因是_____________________ ________________________________________________________________. |
| 结论 | ①分析A、B实验可以得出的结论是:______________________________. ②加热__________(填“能”或“不能”)促进过氧化氢分解产生氢气. |
为研究二氧化锰、加热对过氧化氢分解的影响,某同学设计了如下实验:
| 实验步骤(夹持固定装置已略去) | A、B、C三支试管中分别盛有等体积5%的过氧化氢溶液,如下图所示进行实验.仪器a的名称是__________,C中用于加热仪器的名称是_________.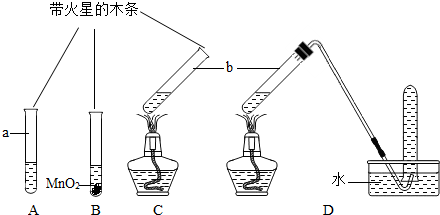 |
| 实验现象 | A:试管壁有气泡附着,带火星的木条不复燃. B:有大量气泡产生,带火星的木条复燃. C:有大量气泡产生,带火星的木条不复燃. D:有大量气泡产生,用带火星的木条检验收集的气体,木条复燃. |
| 分析 | B试管中发生反应的化学方程式是______________. 实验结束后仪器b中的液体质量都减少,原因是_____________________ ________________________________________________________________. |
| 结论 | ①分析A、B实验可以得出的结论是:______________________________. ②加热__________(填“能”或“不能”)促进过氧化氢分解产生氢气. |