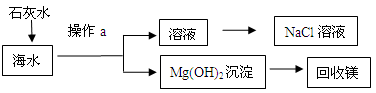
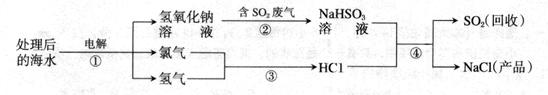
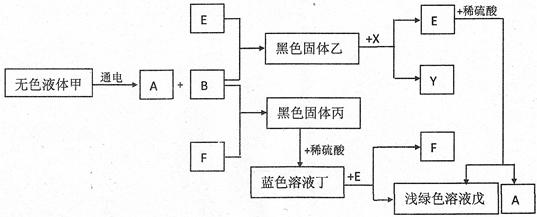
题目内容
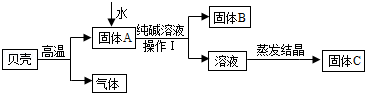
为了将氯化钠和氯化钙的混合物分离,并测定其中氯化钠的质量分数,兴趣小组最初设计了如下方案并进行实验: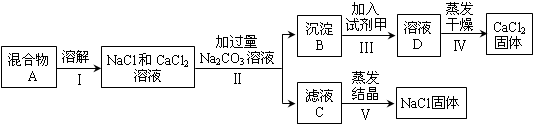
根据流程图回答:
(1)沉淀B化学式是 ,试剂甲是 ,滤液C中溶质成分有 。
(2)步骤Ⅱ加入Na2CO3溶液后,分离出沉淀B的实验操作名称是 。
(3)根据以上方案得到NaCl固体测定含有杂质,同学们通过分析后对上述方案作出改进:
在步骤Ⅴ滤液C蒸发结晶之前,先滴加盐酸至不再产生气泡为止,既能除去所含杂质,又能有效防止新杂质的引入,上述反应的化学方程式为 。
(4)为测定原混合物中氯化钠的质量分数,同学们分别提出了如下两个数据测定方案。
方案1:称量混合物A的总质量和干燥的沉淀B或CaCl2固体的质量,并进行计算;
方案2:称量混合物A的总质量和实验改进后所得纯净氯化钠固体的质量,并进行计算。
请你判断:上述所选称量数据不合理的是 (填:“方案1”或“方案2”)。理由是 。
(1)CaCO3 稀盐酸(HCl) NaCl、Na2 CO3
(2)过滤
(3)Na2CO3+2HCl→2NaCl+H2O+CO2↑
(4)方案2 方案2实验改进后所得纯净氯化钠固体的质量大于原混合物中氯化钠的质量。
解析试题分析:此题属于框图式兼叙述型的推断题,解题时应根据实验的过程,结合实验过程的现象加以分析,在氯化钠和氯化钙的混合溶液中,加入过量的碳酸钠溶液,发生了反应:CaCl2+Na2CO3=CaCO3↓+2NaCl,故沉淀B就是碳酸钙,不难分析出试剂甲应是稀盐酸,溶液D即CaCl2溶液,而滤液C除了有NaCl外,还有过量的Na2CO3
(1)沉淀B化学式是:CaCO3,试剂甲是稀盐酸(HCl),滤液C中溶质成分有:NaCl、Na2CO3
(2)分离出沉淀B的实验操作名称是:过滤
(3)因为滤液C中含有NaCl、Na2CO3,故为了得到纯净的NaCl晶体,应加入稀盐酸,反应的化学方程式为:Na2CO3+2HCl→2NaCl+H2O+CO2↑
(4)所选称量数据不合理的是方案2,因为实验改进后所得纯净氯化钠固体的质量大于原混合物中氯化钠的质量
考点:框图式兼叙述型的推断题,酸、碱、盐的化学性质

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案已知粉末X是下列四种物质中的一种,取三等份该粉末,分别加入到足量的碳酸钠溶液、硝酸银溶液、稀盐酸中并振荡,产生的现象如下表.则该固体粉末X是
| 加入物质 | 碳酸钠溶液 | 硝酸银溶液 | 稀盐酸 |
| 现 象 | 产生白色沉淀 | 产生白色沉淀 | 固体溶解 |
如图是甲、乙两种固体物质的溶解度曲线.
(1)在t1℃时,甲、乙两种固体物质的溶解度 (填相等或不相等);
(2)把甲物质的不饱和溶液变成饱和溶液,下列有关说法正确的是 (填字毋序号);
| A.溶剂的质量一定变小 |
| B.溶质的质量一定不变 |
| C.溶质的质量分数一定变大 |
| D.溶液的质量可能不变 |
(3)在实验室中,用固体物质甲和水配制成一定溶质质量分数的溶液,需用到的仪器有:托盘天平、烧杯、药匙、胶头滴管和 .