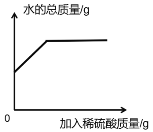
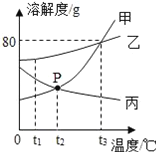
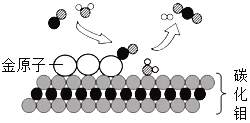
题目内容
【题目】如图为元素周期表中某一周期元素的原子结构示意图。
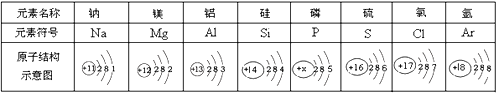
请回答下列问题:
(1)表中磷原子的核电荷数x=__________.
(2)表中具有相对稳定结构的元素是___________.
(3)一个铝离子的符号是____________,若某种铝原子的相对原子质量为27,则它的中子数为__________.
(4)上述元素原子的共同点是____________.
【答案】15 氩(Ar) Al3+ 14 核外电子层数相同
【解析】
(1)原子中,质子数=核外电子数,磷原子的核电荷数x=2+8+5=15;
(2)最外层具有8个电子的原子具有相对稳定结构,表中具有相对稳定结构的元素氩(Ar)元素;
(3)铝原子最外层电子数为3,容易失去3个电子,铝离子的符号是Al3+;中子数=相对原子质量-质子数=27-13=14;
(4)由元素周期表中某一周期元素的原子结构示意图可以看出,处于同一周期的原子,核外电子层数相同。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目