题目内容
【题目】1911年著名物理学家卢瑟福等人为探索原子的内部结构进行了如下实验。他们用一束质量远大于电子的高速运动的α粒子轰击金箔,发现:“大多数α粒子能穿过金箔,一小部分发生偏转,极少数被反弹回来。”回答下列问题:
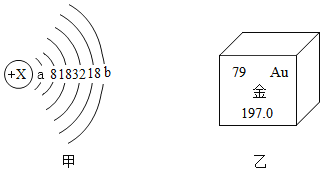
(1)1个α粒子由2个中子和2个质子构成,则α粒子带________电(填“正”或“负”),1个α粒子与1个He-4原子构成上的差别是________。
(2)甲图为金的原子结构示意图,乙图摘自元素周期表,据此推断a=________,b=________。
(3)根据实验现象中α粒子“大多数”与“极少数”的对比分析,你能想象出关于Au原子结构的结论是________。
【答案】正 α粒子中没有电子,1个He-4原子中含有2个电子 2 1 相对原子来说,原子核很小,原子质量主要集中在原子核上
【解析】
(1)1个α粒子由2个中子和2个质子构成,则α粒子带正电,1个α粒子与1个He-4原子构成上的差别是:α粒子中没有电子,1个He-4原子中含有2个电子。故填:正;α粒子中没有电子,1个He-4原子中含有2个电子
(2)第一层电子数最多是2,因此a=2,b=79-2-8-18-32-18=1。故填:2;1
(3)根据实验现象中α粒子“大多数”与“极少数”的对比分析可知,Au原子结构的结论是相对原子来说,原子核很小,原子质量主要集中在原子核上。故填:相对原子来说,原子核很小,原子质量主要集中在原子核上

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】钙片的标签如图所示,且知此钙片成分中只有碳酸钙中含有钙元素,此标签中的含钙量是否正确?
(1)______(填“正确”或“错误”),为测定其含钙量,小东每次取10片钙片放入已称量的含足量稀盐酸的烧杯中,充分反应后再称取烧杯和剩余物的总质量,小东做了三次实验数据如下:
物质的质量 | 第1次 | 第2次 | 第3次 | 平均值 |
反应前:烧杯+稀盐酸 | 22g | 22g | 22g | 22g |
10片钙片 | 8g | 8g | 8g | 8g |
反应后:烧杯+稀盐酸 | 26.7g | 26.5g | 26.9g | 26.7g |
(2)每片钙片中含碳酸钙质量是____g
(3)通过小东的实验,你建议厂家如何修改标签?______。

【题目】兴趣小组的同学学习了碳酸钠的性质后,对碳酸氢钠的性质也进行探究。
(问题1)碳酸氢钠溶液与碳酸钠溶液的酸碱性
(实验1)用pH试纸测定等浓度的碳酸氢钠和碳酸钠溶液的pH,分别为9和12;
(结论1)两种溶液都呈碱性,它们的碱性强弱顺序为_____。
(问题2)碳酸氢钠溶液、碳酸钠溶液与酸的反应
(实验2)等浓度的碳酸氢钠和碳酸钠溶液分别与相同浓度的盐酸反应
操作和现象如下表:
序号 | 操作 | 现象 |
实验① | 碳酸氢钠溶液逐滴加入盐酸中 | 立刻产生气泡 |
实验② | 碳酸钠溶液逐滴加入盐酸中 | 立刻产生气泡 |
实验③ | 盐酸逐滴加入碳酸氢钠溶液中 | 立刻产生气泡 |
实验④ | 盐酸逐滴加入中碳酸钠溶液中 | 滴加一会后才有气泡产生 |
(问题3)实验④与另外三个实验现象不同的原因
(实验3)将等浓度的碳酸氢钠和碳酸钠溶液与相同浓度的盐酸互滴,利用手持传感器测定反应中溶液pH变化,四个实验的pH变化与时间的关系如图所示。
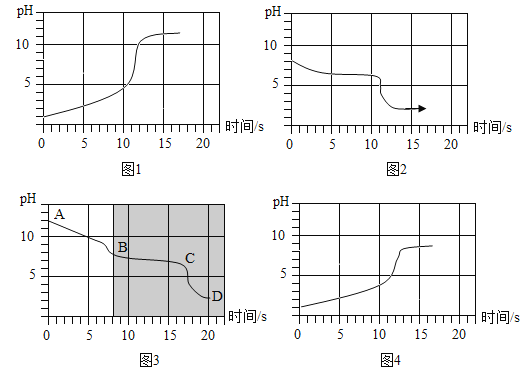
(分析)
(1)如图表示的实验是_____(填实验2中的序号)。
(2)比较如图与如图发现:如图中的阴影部分与如图叠合后,图象基本重合。
则如图中的AB段发生反应的化学方程式为_____,BC段发生反应的化学方程式为_____,D点的溶质为_____(写化学式);所以,“盐酸逐滴加入碳酸钠溶液中,滴加一会后才有气泡产生”的原因是_____。
(3)比较如图与如图发现:不同的操作有不同现象,试分析造成这一现象的原因:_____。
(应用)
用稀盐酸来鉴别一瓶溶液是氢氧化钠还是碳酸钠时,应如何操作? _____。