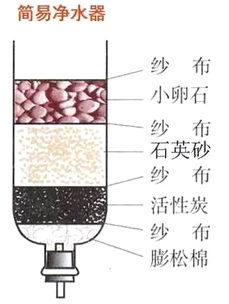
题目内容
【题目】化学实验室现有一瓶无色液体 A 和一包固体混合物 B,小瑾同学想探究它们各自的成分组成。已知样品 A 中可能含有 KNO3、HCl、BaCl2、Ba(NO3)2 中的一种或多种,样品 B 中可能 含有 CaO 和 CaCl2 中一种或两种。小瑾同学按下图所示进行了实验探究,出现的现象如图中所述。(设过程中所有可能发生的反应都恰好完全进行)
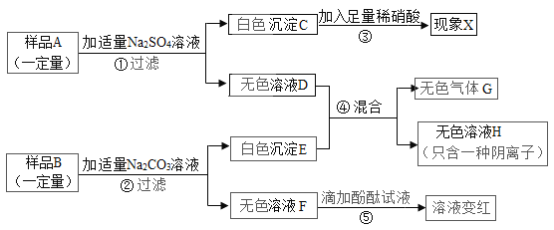
根据上述信息,试回答下列问题:
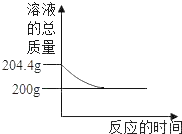
(1)沉淀 C 的化学式为___________,现象 X 为___________, 溶液 F 的 pH___________7(填“<”、 “>”或“=”)。
(2)溶液 D 中,一定大量存在的阳离子是___________ (写离子符号)。
(3)写出步骤②中发生反应的一个化学方程式:___________。
(4)根据上述信息,可推知样品 B 中一定存在的物质是___________ (写化学式)。
(5)根据上述信息,可推知样品 A 中一定存在的物质是________ (写化学式), 你的理由是_______
【答案】BaSO4 白色沉淀不溶解(或 白色沉淀不消失) > H+、Na+ CaO + H2O = Ca(OH)2或 Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH CaO HCl、BaCl2 由图可知,①溶液 D 与沉淀 E 混合会生成无色气体 G, 则 D 中有酸含H+, 即样品 A 中含有 HCl ;白色沉淀 C 是 BaSO4,则样品 A 中一定含有 Ba2+,且 A 与 D 中均有 HCl , 则溶液 H 中只含一种阴离子Cl-,即样品 A 中没有 Ba(NO3)2、KNO3,一定有 BaCl2
【解析】
样品A加适量硫酸钠溶液,产生白色沉淀C和无色溶液D,则C为硫酸钡,说明样品A中一定含有Ba2+,向硫酸钡中加入一定量的稀硝酸,白色沉淀不溶解。样品B加入少量的碳酸钠溶液,生成白色沉淀E和无色溶液F,则白色沉淀E为碳酸钙。碳酸钙与无色溶液D混合,产生无色气体G和无色溶液H,说明无色溶液D中含有稀盐酸。无色溶液H中只含一种阴离子(即碳酸钙与稀盐酸反应生成的氯化钙中的氯离子),由此可知,样品A中一定含有BaCl2,溶液D中有氯化钡与硫酸钠反应生成的氯化钠。无色溶液F滴加酚酞溶液后,溶液变红,说明无色溶液F显碱性。从而可知,样品B中一定含有氧化钙。
(1)由分析知,沉淀 C 为硫酸钡,化学式为BaSO4,现象 X 为白色沉淀不溶解(或 白色沉淀不消失), 溶液 F 显碱性,pH>7;
(2)由分析知溶液 D 主要成分是氯化钠和稀盐酸,故溶液 D 中,一定大量存在的阳离子是H+、Na+;
(3)由分析可知,样品B中一定含有氧化钙,故步骤②中发生反应的一个化学方程式:CaO + H2O = Ca(OH)2或 Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH;
(4)由分析可知,样品B中一定含有氧化钙,化学式为CaO;
(5)由分析可知,样品 A 中一定存在的物质是HCl、BaCl2,理由是:由图可知,①溶液 D 与沉淀 E 混合会生成无色气体 G, 则 D 中有酸含 H+, 即样品 A 中含有 HCl ;白色沉淀 C 是 BaSO4,则样品 A 中一定含有 Ba2+,且 A 与 D 中均有 HCl , 则溶液 H 中只含一种阴离子 Cl-,即样品 A 中没有 Ba(NO3)2、KNO3,一定有 BaCl2。

【题目】在一密闭容器中放入X、Y、M、N四种物质,在一定条件下发生化学反应,一段时间后,测得有关的数据如下,则关于此反应认识正确的是( )
物质 | X | Y | M | N |
反应前质量(g) | 16 | 2 | 35 | 5 |
反应后质量(g) | 3 | 17 | 13 | 待测 |
A.该反应一定是置换反应B.反应中X和Y的质量比为8:1
C.反应后N的质量为25D.该反应X和Y都是反应物