题目内容
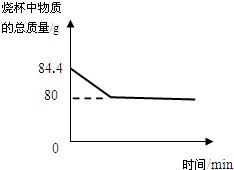 某化学兴趣小组的同学为测定石灰石样品中碳酸钙的含量(杂质不溶于水也不溶于酸),同学们取石灰石样品16克,放入68.4克盐酸中,测得物质总质量的变化如图所示,求:
某化学兴趣小组的同学为测定石灰石样品中碳酸钙的含量(杂质不溶于水也不溶于酸),同学们取石灰石样品16克,放入68.4克盐酸中,测得物质总质量的变化如图所示,求:(1)原混合物中碳酸钙的含量;
(2)反应后所得溶液中溶质的质量分数.
分析:(1)因为碳酸钙和盐酸反应后会产生二氧化碳气体,所以烧杯中物质总质量会减少,根据质量守恒定律可知,烧杯中物质总质量的减少量就是生成的二氧化碳的质量,根据化学方程式利用二氧化碳的质量可得到碳酸钙的质量;
(2)根据碳酸钙和盐酸反应的化学方程式,利用二氧化碳的质量可求出生成的氯化钙的质量,进而求出氯化钙的质量分数,其中反应后溶液的质量=参加反应的固体质量+液体质量-生成的沉淀质量-生成的气体质量.
(2)根据碳酸钙和盐酸反应的化学方程式,利用二氧化碳的质量可求出生成的氯化钙的质量,进而求出氯化钙的质量分数,其中反应后溶液的质量=参加反应的固体质量+液体质量-生成的沉淀质量-生成的气体质量.
解答:解:(1)通过图象可知,反应产生的二氧化碳的质量为:84.4g-80g=4.4g
设原混合物中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
x y 4.4g
=
x=10g
(2)设反应产生的CaCl2的质量为y
=
y=11.1g
反应后溶液质量=10g+68.4g-4.4g=74g
所以反应后CaCl2的质量分数为:
×100%=15%
答:(1)原混合物中碳酸钙的含量是10g;
(2)反应后所得溶液中溶质的质量分数是15%.
设原混合物中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
x y 4.4g
| 100 |
| 44 |
| x |
| 4.4g |
x=10g
(2)设反应产生的CaCl2的质量为y
| 111 |
| 44 |
| y |
| 4.4g |
y=11.1g
反应后溶液质量=10g+68.4g-4.4g=74g
所以反应后CaCl2的质量分数为:
| 11.1g |
| 74g |
答:(1)原混合物中碳酸钙的含量是10g;
(2)反应后所得溶液中溶质的质量分数是15%.
点评:此题是和图象相结合的化学方程式的计算题,此题要分析清题意,看懂图象并利用图象中给出的数据来做题,另外要掌握质量分数的公式,难度适中.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
 12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
 (2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹.
(2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹. 某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.