题目内容
【题目】某兴趣小组对石灰石样品进行如下实验取12g样品放入烧杯中,将100g稀盐酸分4次加入到烧杯中,充分反应后(杂质不溶于水,也不与酸反应),测得剩余固体的质量记录如下。请计算:
1 | 2 | 3 | 4 | |
加入稀盐酸的质量/g | 25 | 25 | 25 | 25 |
剩余固体的质量/g | 8 | 4 | 2 | 2 |
(1)样品中碳酸钙的质量为_________g:
(2)所用稀盐酸中溶质的质量分数_____。(写出计算过程)
【答案】10 11.68%
【解析】
石灰石主要成分是碳酸钙,和稀盐酸反应生成氯化钙和二氧化碳和水,由于杂质不反应,则根据前两次都是固体减少4g,第三次只减少2g,说明此时已经反应完全,剩余的固体为杂质,碳酸钙的质量为12g2g=10g, ![]() 。
。
(1)根据前两次都是固体减少4g,第三次只减少2g,说明此时已经反应完全,剩余的固体为杂质,样品中的碳酸钙的质量为12g2g=10g。
(2)由题意可知每25g稀盐酸与4g碳酸钙完全反应,
设每25g稀盐酸中氯化氢质量为x
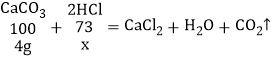
![]()
x=2.92g
所用稀盐酸中溶质的质量分数为:
![]()
答:所用稀盐酸中溶质的质量分数为11.68%。

 天天练口算系列答案
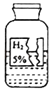
天天练口算系列答案【题目】某学习小组同学在协助老师整理化学试剂时,发现一瓶标签残缺的无色液体,如图所示。他们对此瓶无色液体是什么,进行了如下探究。
(猜想与假设)
小明同学的猜想是:水;小红同学的猜想是:稀硫酸;小玲同学的猜想是:过氧化氢溶液。学习小组同学对标签进行了仔细观察、分析,他们一致认为小明的猜想不合理,其理由是_____。
(活动与探究)
根据以上讨论,小组同学对合理的猜想进行如下实验探究。请你帮助完成下列实验报告:
猜想 | 操作步骤 | 实验现象 | 结论和化学方程式 |
过氧化氢溶液 | a._____。 | b._____。 | 小玲的猜想不成立。 |
稀硫酸 | 取少量该溶液加入盛有 锌粒的试管中,并将一根 燃着的木条置于试管口。 | c._____。 | 小红的猜想成立,反应 的化学方程式为:d._____。 |
(探究质疑)
有同学认为小红同学的猜想除了是硫酸外还有可能是碳酸。碳酸可以通过加热分解的方式进行验证,碳酸分解的方程式为:_____。
(交流反思)
该实验告诉我们,进行化学实验必须掌握好化学反应的原理,仪器的选择,以及药品的_____方法,避免标签损伤。