题目内容
【题目】下表是氯化铵与硝酸钾在不同温度时的溶解度,请回答问题。
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
(1)将60℃时的NH4Cl和KNO3的饱和溶液同时降温到10℃,析出晶体最多是___(填“NH4Cl”“KNO3”或“无法确定”)。
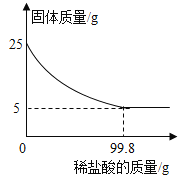
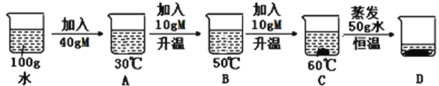
(2)下图中M是氯化铵或硝酸钾中的一种,按图进行相关操作,其中属于不饱和溶液的是______(填字母)。
(3)下图A、B、C、D四个烧杯中溶质质量分数的大小关系是_________;D中溶液的质量为______g。
【答案】无法确定 AB A<B<C=D 77.6
【解析】
(1)60℃时的NH4Cl和KNO3的饱和溶液的质量是否相等不明确,故同时降温到10℃,析出晶体的质量无法确定其多少;
(2)结合图表可知,30℃时氯化铵或硝酸钾的溶解度均大于40g;故100g水中加入40gM,形成30℃时的A溶液,此时属于不饱和溶液;A中加入10gM后,升温到50℃时的B溶液,结合图表可知,50℃时氯化铵或硝酸钾的溶解度均大于50g,故此时属于不饱和溶液;C、D中存在未溶解的固体,属于饱和溶液;
(3)A中溶质质量分数为:![]() ×100%≈28.6%,B中溶质质量分数为:
×100%≈28.6%,B中溶质质量分数为:![]() ≈33.3%,A的溶质质量分数<B的溶质质量分数。C是在B(不饱和溶液)中加入10gM后升温到60℃时形成的饱和溶液(饱和且有未溶解的固体),C中溶质质量比B中多,溶剂质量相等,故B的溶质质量分数<C的溶质质量分数。C、D是同一温度下的饱和溶液,温度不变,饱和溶液溶质质量分数相等,故C、D的溶质质量分数相等。因此A、B、C、D四个烧杯中溶质质量分数的大小关系是A<B<C=D;
≈33.3%,A的溶质质量分数<B的溶质质量分数。C是在B(不饱和溶液)中加入10gM后升温到60℃时形成的饱和溶液(饱和且有未溶解的固体),C中溶质质量比B中多,溶剂质量相等,故B的溶质质量分数<C的溶质质量分数。C、D是同一温度下的饱和溶液,温度不变,饱和溶液溶质质量分数相等,故C、D的溶质质量分数相等。因此A、B、C、D四个烧杯中溶质质量分数的大小关系是A<B<C=D;
由表中数据可知,60℃时,氯化铵的溶解度为55.2g,硝酸钾的溶解度为110g。图中向50℃的B溶液中加入10gM后升温到60℃,形成C(饱和且有未溶解的固体),由此可知M是氯化铵。故D中溶解的溶质的质量为55.2g×![]() =27.6g,D中溶液的质量为50g+27.6g=77.6g。
=27.6g,D中溶液的质量为50g+27.6g=77.6g。

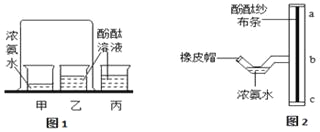
【题目】在研究酸和碱的化学性质时,同学们想证明:稀H2SO4与NaOH溶液确实发生了反应。请你与他们一起完成实验方案设计、实施和评价。(注:硫酸钠溶液呈中性)
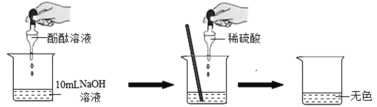
(1)向NaOH溶液中滴入2~3滴酚酞溶液,溶液由无色变为____色。
(2)根据上述实验中颜色变化,确定稀H2SO4与NaOH溶液发生了化学反应,反应的化学方程式为__。
(3)因为溶液变成了无色,小林说“稀硫酸一定过量了”,小林这么说的理由是___。
(4)为确定小林的说法是否正确,同学们又设计了下列实验方案并进行实验:
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 稀H2SO4过量 |
方案二 | 取样,滴入2-3滴紫色石蕊溶液 | 溶液变成红色 | 稀H2SO4过量 |
上述方案中,你认为正确的是____(填“方案一”或“方案二”)。另外一个实验方案错误的原因(用化学方程式表示):____。
【题目】醋是中国传统的调味品,市场上售卖的某一品牌白醋,标签说明,除了3%~5%的醋酸(CH3COOH)和水之外不含或极少含其他成分,请回答相应问题。
(1)白醋是____________(填“纯净物”或“混合物”),醋酸分子中氢、氧原子个数比为_____________。
(2)酿醋原理是在醋酸菌作用下乙醇(CH3CH2OH)与氧气反应,除生成醋酸外,还有另一产物,请写出该反应的化学方程式________________。
(3)某同学对白醋的性质进行如下探究。
实验操作 | 实验现象 | 实验结论与解释 |
①向白醋中滴入______ | 观察到溶液变红 | 白醋显酸性 |
②向镁粉中滴加白醋直至过量 | __________________ | 白醋能与活泼金属反应 |
③将白醋滴加到碳酸钙表面 | 有少量气泡产生 | 反应的化学方程式是_________ |
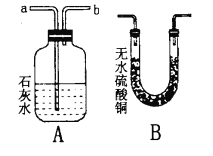
(4)若用如图装置验证水和二氧化碳两种气体生成物,应将生成的混合气体先通过_________装置,反之会有何影响?_______________。若将气体通入装置A进行验证时,气流应从_______________口通入。