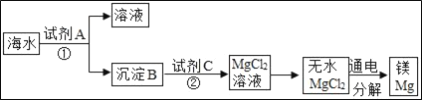
��Ŀ����
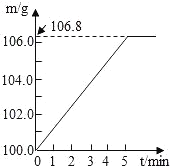
����Ŀ��ijͬѧΪ�˼�����ﹺ�������炙����Ƿ�ϸ�����ȡ27.5g������Ʒ������Ũ�ռ���Һ���ȣ������İ�����100.0g���������ա�������հ�������Һ������m�뷴Ӧʱ��t�ı仯��ͼ��ʾ����������ǡ����ȫ��Ӧ�������漰�ķ�ӦΪ����NH4��2SO4+2NaOH�TNa2SO4+2H2O+2NH3���� 2NH3+H2SO4�T��NH4��2SO4������㣺
��1����ȫ��Ӧ���������_____g��
��2���û��ʵĺ�����Ϊ_____����ȷ��0.1%���������ֻ�������_____ ������ϸ��ϸ��ϸ�����狀�����Ϊ20%���ϣ���Ʒ��
��3���������������������������_____��д��������̣���
���𰸡�6.8 20.4% �ϸ� 19.6%
��������
�⣺��1�����������غ㶨�ɽ������ͼʾ��֪���ɵİ�������Ϊ106.8g��100g��6.8g��
��2�����������غ㶨�ɰ����еĵ�Ԫ������������炙����е�Ԫ�ص������������е�Ԫ�ص�����Ϊ6.8g��![]() ��5.6g���ʻ����е�Ԫ�ص���������Ϊ
��5.6g���ʻ����е�Ԫ�ص���������Ϊ![]() ��100%��20.4%�������ֻ������ںϸ��Ʒ��
��100%��20.4%�������ֻ������ںϸ��Ʒ��
��3������Һ�����������Ϊx��
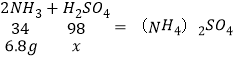
![]()
x��19.6g��
���������������������������![]() ��100%��19.6%��
��100%��19.6%��
����Һ�������������������Ϊ19.6%��

 ��ҵ����ϵ�д�
��ҵ����ϵ�д� ͬ��ѧ��һ�ζ���ϵ�д�
ͬ��ѧ��һ�ζ���ϵ�д�����Ŀ��ʵ��С��Թ��������ijЩ���ʽ���̽��
���������ϣ�����������һ�������ֽ�����ʣ�ijЩƯ��Һ�к��й���������Һ������������Һ��Ư��һЩ��ɫ����
������ʵ�飩
ʵ��A����������10%�Ĺ���������Һ����һ���ɫ��������ͼ��ʾ��������ʱ���벼����ɫ�仯���±�
����ʱ�� | 20min | 40min | 60min |
������ɫ�ı仯 | �����Ա仯 | ��ɫ�Ա�dz | ��ɫ���Ա�dz |
ʵ��B���ı�ʵ�������ٽ���4��ʵ�飬�������±�
��� | �� | �� | �� | �� |
ʵ������ | 20��25mL 10%H2O2��Һ | 50��25mL 10%H2O2��Һ | 20��25mL 10%H2O2��Һ +2mLNaOH��Һ | 50��25mL 10%H2O2��Һ +2mLNaOH��Һ |
������ɫ�ı仯 ��20min�� | �����Ա仯 | ��ɫ�Ա�dz | ��ɫ�Ա�dz | ��ɫ���Ա�dz |
��1��ʵ��A�Ľ�����_____
��2��ʵ��B�У����ó�������������ͬʱ�������¶ȿ�ʹ����������Һ��Ư������ǿ���Ľ��ۣ���Ҫ�Ա�ʵ��_____�����ţ�
��3��ʵ��B�У�ͨ���ԱȢڢܣ��ó��Ľ�����_____
��4�������ʵ����������Ư��Һ��ʹ���¶Ȳ��˹��ߣ��Ʋ���ԭ����_____
����Ŀ�����dz�����ͼ1����װ�ý���ʵ�飺
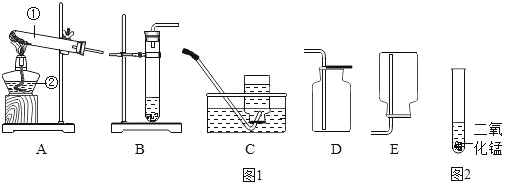
��1�������������������_____��_____
��2���������ʵ������ȡ�����Ļ�ѧ����ʽ����ѡ���Ӧ��ʵ������ȡ�����ķ���װ�ú��ռ�װ�ã�����ĸ��ţ���ͬ����
������л�ѧ��Ӧ�Ļ�ѧ����ʽ | ����װ�� | �ռ�װ�� |
���������_____ | _____ | _____ |
�������_____ | _____ | _____ |
����������_____ | _____ | _____ |
��3��ʵ������CO2�Ļ�ѧ����ʽ��_____��ʵ������ȡH2�Ļ�ѧ����ʽ��_____��
��4��ʵ���ҳ��ü��ȹ�������ҵĻ��������ȡ�����������ȡ��ѡ�õķ���װ����_____�����ռ������ʱֻ����Eװ�ã������֪�������ʿ�����_____��
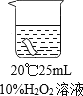
��5��ijѧ��ѧϰ��˫��ˮ��������ʵ��������Լ�����Ҳ��һƿ������˫��ˮ�����ڱ�ǩ�Ѳ����������ж����Ƿ���ʣ�����������ƿ��Һ����ѧУ����������ͼ2��ʾ���о����Իش�
������������̵�������_____��
���������Һδ���ʣ�Ӧ�ù۲쵽��������_____�������ܹ۲쵽��������˵����ƿ˫��ˮ�Ѿ����ʳ�_____��
����δ���ڵ�����˫��ˮ�����˿��ϣ���Ѹ�ٳ��ִ������ݣ�����Ϊ��������_____��